
科目: 来源: 题型:
【题目】融雪剂通过降低冰雪融化温度的原理融化道路上的积雪。研究发现,一般融雪剂残留物可腐蚀路面和汽车轮胎等。目前我国北方在冬季仍采用沙土和铲雪车为主,融雪剂为辅的方式清除路面冰雪,保证道路通畅。
请回答下列问题:
(1)氯化钙是常用融雪剂的主要成分之一,以工业碳酸钙(含有少量Na+、Mg2+、Fe3+等杂质)生产氯化钙的主要流程如下:

①流程中试剂W的名称是 ________________。
②流程中滤渣的主要成分是________________(填化学式)。
③流程中操作Y的目的是_______________。
④如果用惰性电极电解用试剂W溶解后的溶液,则电解开始时阴极发生的电极反应式为_________。
(2)下列就融雪剂使用的有关原理的解释正确的是_________________。
A.“会加快冰雪的融化”是因为提高了冰点
B.“会造成绿化植物死亡”是与盐析有关
C.“会造成土壤板结贫瘠”是与物质的分解吸热有关
D.“会加快路基上铁的腐蚀”是与形成原电池有关
(3)某公司生产的融雪剂由NaCl、NaNO3、AlCl3、CuSO4、K2CO3中的几种物质组成。某同学设计下列过程探究其组成:
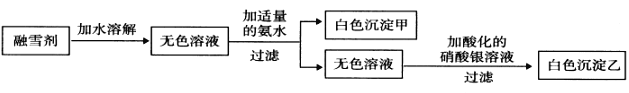
请回答下列问题:
①该融雪剂中一定不含的物质是_________________(填名称)。
②若取融雪剂样品a g,通过上述探究途径得白色沉淀乙bmol,则该融雪剂中含氯元素的质量分数为 ____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g),下列证据能说明反应一定达到化学平衡状态的是
2SO3(g),下列证据能说明反应一定达到化学平衡状态的是
A.容器内的压强不再改变B.c(SO2):c(O2):c(SO3)=2:1:2
C.混合气体的密度不再改变D.SO2的生成速率与SO3的消耗速率相等
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) △H<0,下列研究目的和示意图相符的是( )
2NH3(g) △H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响 (p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图。下列叙述中正确的是

A.反应的化学方程式为![]()
B.![]() 时,Y的浓度是X浓度的
时,Y的浓度是X浓度的![]() 倍
倍
C.根据![]() 时的数据,可求出该温度下的平衡常数
时的数据,可求出该温度下的平衡常数
D.![]() 时,逆反应速率大于正反应速率
时,逆反应速率大于正反应速率
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇、天燃气是重要的化工原料,又可作为燃料.利用合成气![]() 主要成分为CO、
主要成分为CO、![]() 和
和![]() 在催化剂的作用下合成甲醇、甲烷.已知合成甲醇发生的主反应如下(已知CO的结构式为C=O):①
在催化剂的作用下合成甲醇、甲烷.已知合成甲醇发生的主反应如下(已知CO的结构式为C=O):①![]() ,②
,②![]() ,③
,③![]() 。
。
回答下列问题:
(1)已知反应①中相关的化学键能数据如下:
化学键 |
|
|
|
|
|
| 436 | 343 | 1076 | 465 | 413 |
由此计算![]() ______
______ ![]() 已知
已知![]() ,则
,则![]() ______。
______。
(2)在容积为![]() 的容器中,通入一定量的甲醇发生反应①
的容器中,通入一定量的甲醇发生反应①![]() 时,体系中各物质浓度随时间变化如图所示(平衡时甲醇的转化率记作a1)。
时,体系中各物质浓度随时间变化如图所示(平衡时甲醇的转化率记作a1)。

①在![]() 时段,反应速率
时段,反应速率![]() 为 ______ ;该反应的平衡常数
为 ______ ;该反应的平衡常数![]() 的计算式为 ______ 。
的计算式为 ______ 。
②已知若在恒压条件下进行,平衡时![]() 的转化率
的转化率![]() ______
______ ![]() 填“大于”或“小于”、“等于”
填“大于”或“小于”、“等于”![]() ,判断理由是 ______ 。
,判断理由是 ______ 。
(3)合成![]() 的原理:
的原理:![]() 其他条件相同,实验测得在
其他条件相同,实验测得在![]() 和
和![]() 与
与![]() 和
和![]() 条件下该反应的
条件下该反应的![]() 平衡转化率相同,若
平衡转化率相同,若![]() ,则P1______ P2(填“
,则P1______ P2(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)。
”)。
(4)科学家用氮化镓材料与铜组装如图所示的人工光合系统,利用该装置成功地实现了以![]() 和
和![]() 合成
合成![]() 。
。

①写出铜电极表面的电极反应式 ______。
②为提高该人工光合系统的工作效率,可向装置中加入少量 ______ ![]() 选填“盐酸”或“硫酸”
选填“盐酸”或“硫酸”![]() 。
。
(5)标准状况下,将![]() 的甲烷完全燃烧生成的
的甲烷完全燃烧生成的![]() 通入到
通入到![]() 的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为 ______。
的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为 ______。
查看答案和解析>>
科目: 来源: 题型:
【题目】有7种短周期元素的原子序数按A、B、C、D、E、F、G的顺序依次增大;B元素一种原子的含量常用于判定古生物遗体的年代,A和C元素的原子能形成4核10电子的微粒;D和E可形成离子化合物E2D,E2D中所有微粒的电子数相同,且电子总数为30;E、F、G的最高价氧化物对应的水化物之间可以相互反应;G和D同主族。试回答下列问题:
(1)C元素的原子结构示意图____________________。
(2)A和D可形成化合物的化学式为________。
(3)B元素在周期表中的位置为_____________;过量的B元素的最高价氧化物与氢氧化钠溶液反应的离子方程式为________________。
(4)D、E、F、G的离子半径由大到小顺序为(用离子符号表示)__________。
(5)F的单质与E元素的最高价氧化物对应的水化物反应的离子方程式为______,若将该反应设计成原电池,原电池的负极材料为___________。
(6)上述元素形成的二元化合物中,能够用于漂白的气体物质中含有的化学键类型为____,能够用于漂白的固体物质中阴、阳离子个数比为_________________。
(7)写出D元素原子形成的10电子微粒X与G元素原子形成的18电子微粒Y反应的离子方程式:_________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】环境保护是现代的世界性课题,人类已在多方面取得了突破性进展。
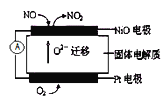
(1)连续自动监测氮氧化物![]() 的仪器--动态库仑仪已获得实际应用.它的工作原理如下图所示,NiO电极上NO发生的电极反应式为 ______。
的仪器--动态库仑仪已获得实际应用.它的工作原理如下图所示,NiO电极上NO发生的电极反应式为 ______。
(2)使用稀土催化剂有效消除汽车尾气中的![]() 、碳氢化合物也已逐渐成为成熟技术.压缩天然气汽车利用这一技术将
、碳氢化合物也已逐渐成为成熟技术.压缩天然气汽车利用这一技术将![]() 、
、![]() 转化成无毒物质,相关反应为:
转化成无毒物质,相关反应为:
①![]()
②![]()
③![]()
则![]() ______(用
______(用![]() 和
和![]() 表示)。
表示)。
(3)实验室在恒压下,将![]() 和
和![]() 置于密闭容器中发生反应③,测得在不同温度、不同投料比时,
置于密闭容器中发生反应③,测得在不同温度、不同投料比时,![]() 的平衡转化率如下表:
的平衡转化率如下表:
投料比 | 400K | 500K | 600K |
1 |
|
|
|
2 |
|
|
|
①在![]() 与
与![]() 反应时,可提高
反应时,可提高![]() 转化率的措施有 ______填编号
转化率的措施有 ______填编号![]() 。
。
A 增加催化剂的表面积 ![]() 改用高效催化剂
改用高效催化剂 ![]() 降低温度
降低温度
D 增大压强 ![]() 分离出
分离出![]()
![]() 减小
减小![]()
②![]() 时,将投料比为1的
时,将投料比为1的![]() 和
和![]() 的混合气体共
的混合气体共![]() ,充入容积为2L的装有催化剂的密闭容器中,反应经过5min达到平衡,试计算反应在该温度时的平衡常数______。(写出计算过程,计算结果保留三位有效数字)
,充入容积为2L的装有催化剂的密闭容器中,反应经过5min达到平衡,试计算反应在该温度时的平衡常数______。(写出计算过程,计算结果保留三位有效数字)
③若温度不变,在反应进行到10min时将容器的容积快速压缩为1L,请在答题卷表格中画出![]() 内,容器中
内,容器中![]() 物质的量浓度c随时间变化的曲线图______。
物质的量浓度c随时间变化的曲线图______。
(4)SNCR是一种新型的烟气脱氮环保技术,在有氧条件下,其脱氮原理是:![]() 和
和![]() 在
在![]() 催化剂表面的反应随温度的变化曲线如图所示,图中曲线表明,随着反应温度的升高,在有氧的条件下NO的转化率有一明显的下降过程,其原因可能是
催化剂表面的反应随温度的变化曲线如图所示,图中曲线表明,随着反应温度的升高,在有氧的条件下NO的转化率有一明显的下降过程,其原因可能是![]() 回答两条
回答两条![]() : ______。
: ______。

查看答案和解析>>
科目: 来源: 题型:
【题目】有M、N、P、Q四块金属片,进行如下实验:
① M、N用导线相连后,同时插入硫酸铜溶液中,N极变粗
②P、Q用导线相连后,同时浸入稀![]() 中,Q是电子流入的一极
中,Q是电子流入的一极
③M、P相连后,同时浸入稀![]() ,P极产生大量气泡
,P极产生大量气泡
④N、Q相连后,同时浸入稀![]() 中,Q极发生氧化反应
中,Q极发生氧化反应
则四种金属的活动性顺序为
A.M>N>P>QB.M>P>Q>NC.N>Q>P>MD.P>M>N>Q
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用0.100 mol·L-1的NaOH溶液滴定20.00 mL 0.100 mol·L-1的HNO2溶液,![]() 与所加NaOH溶液体积的关系如图所示,下列说法错误的是( )
与所加NaOH溶液体积的关系如图所示,下列说法错误的是( )

A. 25 ℃时,0.100 mol·L-1的HNO2溶液的pH=2.75
B. B点对应的溶液中,2c(H+)+c(HNO2)=c(NO2-)+2c(OH-)
C. C点对应的溶液的pH=7,加入NaOH溶液的体积为20.00 mL
D. 滴定过程中从A到D点溶液中水的电离程度先增大后减小
查看答案和解析>>
科目: 来源: 题型:
【题目】锂-空气电池是一种新型的二次电池,其放电时的工作原理如图所示,下列说法正确的是

A. 该电池放电时,正极的反应式为O2+4e-+4H+=2H2O
B. 该电池充电时,阴极发生了氧化反应:Li++e-=Li
C. 电池中的有机电解液可以用稀盐酸代替
D. 充电时,空气极与直流电源正极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com