
科目: 来源: 题型:
【题目】化工生产中常用FeS作为沉淀剂除去工业废水中的Pb2+,反应原理为FeS(s)+Pb2+(aq) ![]() PbS(s)+Fe2+(aq),下列有关叙述错误的是( )
PbS(s)+Fe2+(aq),下列有关叙述错误的是( )
A.达到平衡时,c(Pb2+)=c(Fe2+)
B.Ksp(FeS)大于Ksp(PbS)
C.该反应的平衡常数K=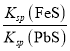
D.溶液中加入少量Na2S固体后,c(Fe2+)减小
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq),化工生产中常用MnS(s)作沉淀剂去除废水中的Cu2+。下列有关说法正确的是( )
CuS(s)+Mn2+(aq),化工生产中常用MnS(s)作沉淀剂去除废水中的Cu2+。下列有关说法正确的是( )
A.当c(Cu2+)=c(Mn2+)时该反应达到平衡
B.从该反应原理可以得出CuS的溶解度比MnS的溶解度大
C.该反应的平衡常数K=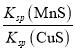
D.往平衡体系中加入少量CuSO4(s)后,c(Mn2+)不变
查看答案和解析>>
科目: 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是( )
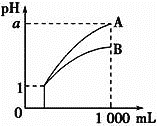
①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A. ①④B. ②③C. ②④D. ①③
查看答案和解析>>
科目: 来源: 题型:
【题目】微量元素硼对植物的生长和人体骨骼的健康有着十分重要的作用。请回答下列问題:
(1)区分晶体硼和无定硼形科学的方法为_________________________________。
(2)下列B原子基态的价层电子排布图中正确的是___________
A. B.
B.
C. D.
D.
(3)NaBH4是重要的储氢载体,阴离子的立体构型为___________。
(4)三硫化四磷分子(结构如下图1所示)是___________分子(填极性”或非极性)。
(5)图2表示多硼酸根离子的一种无限长的链式结构,其化学式可表示为___________。

(6)硼酸晶体是片层结构,其中一层的结构如图3所示。硼酸在冷水中溶解度很小,但在热水中较大,原因是_________________________________。
(7)立方氮化硼(BN)是新型高强度耐磨材料,可作为金属表面的保护层,其晶胞结构(如右图)与金刚石类似。已知该晶体密度为ag/cm3,则晶体中两个N原子间的最小距离为___________pm。(用含a的代数式表示,NA表示阿伏加德罗常数)

查看答案和解析>>
科目: 来源: 题型:
【题目】某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)用_______式滴定管盛装c mol/L盐酸标准液。配制c mol/L盐酸标准液,必须使用的主要容器是____________ 如图表示某次滴定时50 mL滴定管中前后液面的位置。滴定管读数时应注意____________________________________。尖嘴部分应____________________________。用去的标准盐酸的体积是_____________mL

(2)该实验应选用_____作指示剂;操作中如何确定终点?______________________________。
(3)对下列两种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果__________;
b.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果__________;
查看答案和解析>>
科目: 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。

(1)①流程图设备Ⅰ中进行的是操作________(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②由设备Ⅱ进入设备Ⅲ的物质A是______________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是___________。
③在设备Ⅲ中发生反应的化学方程式为_____________________。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过 _________________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是_______、_____________C6H6和CaO。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是____________。
从废水中回收苯酚的方法是①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③加入某物质又析出苯酚。试写出②、③两步的反应方程式:_________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量____________(mg·L-1)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,向10mL0.1mol·L-1MCl2溶液中滴加 0.1mol·L-1的Na2S溶液,滴加过程中溶液中-lgc(M2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
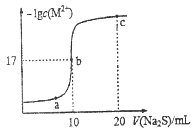
已知:Ksp(NS)=4.0×10-25
A. 该温度下Ksp(MS)=1.0×10-34
B. Na2S溶液中:c(H+)+c(HS-)+c(H2S)=c(OH-)
C. a、b、c三点中,水的电离程度最大的为b点
D. 向NS的悬浊液中加入MCl2溶液,不可能实现NS沉淀转化为MS沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】国家实施“青山绿水工程”,大力研究脱硝和脱硫技术。
(1)H2在催化剂作用下可将NO还原为N2。下图是该反应生成1mol水蒸气的能量变化示意图。写出该反应的热化学方程式___________。

(2)2NO(g)+O2(g)![]() 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:
反应I:2NO(g)![]() N2O2(g)(快);H1<0 v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
N2O2(g)(快);H1<0 v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
反应Ⅱ:N2O2(g)+O2(g)![]() 2NO2(g)(慢);△H2<0 v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2 (NO2);
2NO2(g)(慢);△H2<0 v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2 (NO2);
①一定条件下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。
2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。
反应I的活化能EI___________反应Ⅱ的活化能EII(填“>”、“<”、或“=”)。
②已知反应速率常数k随温度升高而增大,则升高温度后k2正增大的倍数___________k2逆增大的倍数(填“大于”、“小于”、或“等于”)。
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。

①装置中H+向___________池迁移。
②乙池溶液中发生反应的离子方程式:______________________。
(4)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。25°℃,某废液中c(Mn2+)=0.02mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1mol·L-1,此时pH约为___________。(已知:Ksp(MnS)=5.0×10-14,H2S的电离常数:K1=1.5×10-7,K2=6.0×10-15,1g6=0.8)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下用NaOH溶液滴定H2C2O4溶液的过程中,溶液中一lg![]() 和一lgc(HC2O42-)[或-lg
和一lgc(HC2O42-)[或-lg![]() 和-1gc(C2O42-)]的关系如图所示。下列说法正确的是
和-1gc(C2O42-)]的关系如图所示。下列说法正确的是

A. Ka1(H2C2O4)数量级为10-1
B. 曲线N表示-lg![]() 和-lg c(HC2O4-)的关系
和-lg c(HC2O4-)的关系
C. 向NaHC2O4溶液中加NaOH至c(HC2O4-)和c(C2O42-)相等,此时溶液pH约为5
D. 在NaHC2O4溶液中C(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com