
科目: 来源: 题型:
【题目】目前“低碳减排”备受关注,![]() 的产生及有效开发利用成为科学家研究的重要课题。
的产生及有效开发利用成为科学家研究的重要课题。

(1)汽车尾气净化的主要原理为![]() 。在密闭容器中发生该反应时,
。在密闭容器中发生该反应时,![]() 随温度
随温度![]() 、催化剂表面积
、催化剂表面积![]() 和时间
和时间![]() 的变化曲线如图1示。据此判断:
的变化曲线如图1示。据此判断:
①该反应的![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
②在![]() 温度下,
温度下,![]() 内的平均反应速率
内的平均反应速率![]() ______
______![]() 。
。
③当固体催化剂的质量一定时,增大其表面积可增大化学反应速率。若催化剂的表面积![]() ,在答题卡相应图中画出
,在答题卡相应图中画出![]() 在
在![]() 、
、![]() 条件下达到平衡过程中的变化曲线_____。
条件下达到平衡过程中的变化曲线_____。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图如图2正确且能说明反应在进行到![]() 时刻达到平衡状态的是______
时刻达到平衡状态的是______![]() 填代号
填代号![]() 。
。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用![]() 催化还原
催化还原![]() 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。
例如:![]()
![]()
写出![]() 催化还原
催化还原![]() 生成
生成![]() 、
、![]() 和
和![]() 的热化学方程式:______。
的热化学方程式:______。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图3通过人工光合作用,以![]() 和
和![]() 为原料制备HCOOH和
为原料制备HCOOH和![]() 的原理示意图。催化剂b表面发生的电极反应为______
的原理示意图。催化剂b表面发生的电极反应为______
③常温下![]() 的HCOONa溶液pH为10,则HCOOH的电离常数
的HCOONa溶液pH为10,则HCOOH的电离常数![]() ______
______![]() 填写最终计算结果
填写最终计算结果![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.
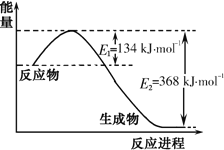
(1)如图是1mol![]() 气体和1molCO反应生成
气体和1molCO反应生成![]() 和NO过程中能量变化示意图。则反应过程中放出的总热量应为______。
和NO过程中能量变化示意图。则反应过程中放出的总热量应为______。
(2)在固定体积的密闭容器中,进行如下化学反应:
![]() ;
;![]() ,其平衡常数K与温度T的关系如下表:
,其平衡常数K与温度T的关系如下表:
| 298 | 398 | 498 |
平衡常数K |
|
|
|
①写出该反应的平衡常数表达式![]() ______。
______。
②试判断K1______ K2 (填写“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
③下列各项能说明该反应已达到平衡状态的是______![]() 填字母
填字母![]() .
.
![]() 容器内
容器内![]() 、
、![]() 、
、![]() 的浓度之比为1:3:2
的浓度之比为1:3:2![]()
![]() 容器内压强保持不变
容器内压强保持不变 ![]() 混合气体的密度保持不变
混合气体的密度保持不变
(3)化合物![]()
![]() 做火箭发动机的燃料时,与氧化剂
做火箭发动机的燃料时,与氧化剂![]() 反应生成
反应生成![]() 和水蒸气。某同学设计了一个
和水蒸气。某同学设计了一个![]()
![]() 空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与
空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与![]() 混合溶液,其装置如图所示:
混合溶液,其装置如图所示:
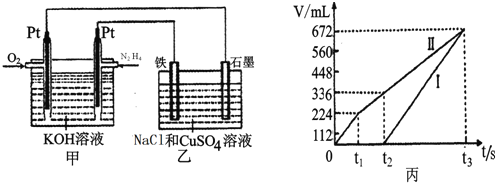
①该燃料电池的负极反应式为______;
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示![]() 气体体积已换算成标准状况下的体积
气体体积已换算成标准状况下的体积![]() ,写出在
,写出在![]() 时间段铁电极上的电极反应式______;原混合溶液中NaCl的物质的量浓度为______。
时间段铁电极上的电极反应式______;原混合溶液中NaCl的物质的量浓度为______。
③在![]() 时所得溶液的pH为______(假设溶液体积不变
时所得溶液的pH为______(假设溶液体积不变![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。用下图所示装置进行第一组实验。
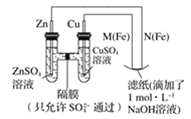
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是_____(填字母序号)。
A.铝 B.石墨 C.银 D.铂
(2)N 极发生反应的电极反应式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.1mol/L CH3COOH溶液加入水稀释或加入少量CH3COONa晶体时,都会引起
A. 溶液中pH增大B. CH3COOH的电离程度变大
C. 溶液的导电能力减弱D. CH3COO-的浓度变小
查看答案和解析>>
科目: 来源: 题型:
【题目】目前有效控制及高效利用CO、![]() 的研究正引起全球广泛关注,根据
的研究正引起全球广泛关注,根据![]() 中国化工报
中国化工报![]() 报道,美国科学家发现了几种新的可将CO、
报道,美国科学家发现了几种新的可将CO、![]() 转化为甲醇的高活性催化体系,比目前工业使用的常见催化剂快近 90倍。
转化为甲醇的高活性催化体系,比目前工业使用的常见催化剂快近 90倍。
已知工业上可以利用![]() 制备
制备![]() 涉及反应如下:
涉及反应如下:
反应I:![]()
反应II:![]()
(1)写出工业上CO和![]() 制取甲醇的热化学方程式 ______ 。
制取甲醇的热化学方程式 ______ 。
(2)反应I能自发进行的条件是 ______。
(3)一定温度下,![]() 、CO在体积固定的密闭容器中发生如下反应:
、CO在体积固定的密闭容器中发生如下反应:![]() ,下列选项能判断该反应达到平衡状态的依据有 ______ 。
,下列选项能判断该反应达到平衡状态的依据有 ______ 。
A.该反应的平衡常数不变
![]() 的消耗速率等于
的消耗速率等于![]() 的生成速率
的生成速率
C.容器内的压强保持不变
![]() 混合气体的密度保持不变
混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(4)500K,![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 的
的 ![]() 和
和![]() 仅发生反应I,该反应10min时生成
仅发生反应I,该反应10min时生成 ![]() ,此时达到平衡:
,此时达到平衡:
①用氢气表示该反应的速率为 ______ 。
②该温度下,反应I的平衡常数为 ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶元素的各种化合物的主要原料。回答下列问题(相关数据如下):
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
Sr(OH)2 | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
ⅡA元素氢氧化物 | Be(OH)2 | Mg(OH)2 | Ca(OH)2 | Sr(OH)2 | Ba(OH)2 | ||||
25℃时饱和溶液浓度molL-1 | 8.00×10-6 | 5.00×10-4 | 2.00×10-2 | 6.00×10-2 | 2.00×10-1 | ||||
I.(1)SrO2中氧元素的化合价为___。Sr(OH)2的碱性比Mg(
(2)工业上可以用SrO与铝粉充分混合,在真空加热反应生成金属锶和3SrO8Al2O3,写出该反应的化学方程式___。
Ⅱ.以天青石(主要含有SrSO4和少量CaCO3杂质)生产Sr(OH)2xH2O的工艺如下:
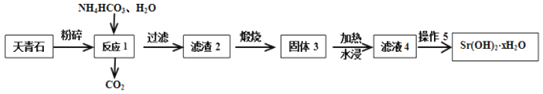
(3)滤渣2为混有CaCO3的SrCO3,写出生成SrCO3的化学方程式___。
(4)加热水浸固体3是为了获得较为纯净的Sr(OH)2涪液,此时应缓慢加热使沉淀颗粒长大,有利于___。
(5)从趁热过滤后的滤液中得到Sr(OH)2xH2O产品的步骤为降温结晶、过滤、洗涤、干燥。为得到较大颗粒的Sr(OH)2xH2O晶体,可采用的方法是___(填一种)。
(6)取m g纯净Sr(OH)2xH2O产品溶于水,加入过量纯碱溶液后过滤、洗涤、干燥后,得到n g滤渣,则x=___(用含m、n的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】曲美替尼是一种抑制黑色素瘤的新型抗癌药物,下面是合成曲美替尼中间体G的反应路线:

已知:①D分子中有2个6元环;

请回答:
(1)化合物A的结构简式___________。A生成B的反应类型___________。
(2)下列说法不正确的是___________。
A.B既能表现碱性又能表现酸性
B.1moC在碱溶液中完全水解最多可以消耗4 molOH-
C.D与POCl3的反应还会生成E的一种同分异构体
D.G的分子式为C16H18O3N4
(3)写出C→D的化学方程式____________________________________________。
(4)X是比A多2个碳原子的A的同系物,写出符合下列条件的X可能的结构简式:_______________________________________________________。
①1H-NMR谱显示分子中有3种氢原子,②IR谱显示分子中有苯环与-NH2相连结构
(5)流程中使用的DMF即N,N-二甲基甲酰胺结构简式为 ,是常用的有机溶剂。设计以甲醇和氨为主要原料制取DMF的合成路线(用流程图表示,其他无机试剂任选)。_____________
,是常用的有机溶剂。设计以甲醇和氨为主要原料制取DMF的合成路线(用流程图表示,其他无机试剂任选)。_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等有重要意义。
(1)用CO可以合成甲醇,已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJmol-1;
O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJmol-1;
CO(g)+![]() O2(g)=CO2(g) △H=-283.0 kJmol-1;
O2(g)=CO2(g) △H=-283.0 kJmol-1;
H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJmol-1;
O2(g)=H2O(l) △H=-285.8kJmol-1;
则CO(g)+2H2(g)![]() CH3OH(g) △H=___kJmol-1。
CH3OH(g) △H=___kJmol-1。
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是___(填写序号)。
a.使用催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为VL的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醛,平衡转化率与温度、压强的关系如图1所示。
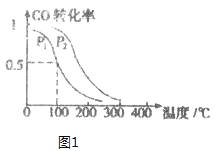
①P1___P2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=______;
③100℃,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、H2、CH3OH各0.5a mol,则平衡___(填“向左”“不”或“想右”)移动。
(4)利用原电池原理,用SO2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触,请写出该电池的负极的电极反应式___;
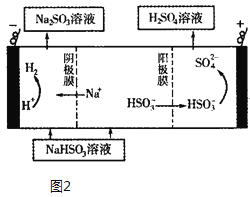
(5)Na2SO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为______。用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液,电解原理示意图如图2所示。请写出该电解池发生反应的化学方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】把足量熟石灰放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq),下列叙述不正确的是( )
Ca2+(aq)+2OH-(aq),下列叙述不正确的是( )
A.给溶液加热,Ca(OH)2的溶解度减小
B.向溶液中加入少量CaO充分反应后,恢复到原温度,溶液的pH升高
C.温度不变,向溶液中加入少量Na2CO3固体,充分反应后,Ksp[Ca(OH)2]不变
D.向溶液中加入少量的NaOH固体,Ca(OH)2固体增多
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯是高效、低毒的消毒剂。已知:ClO2是极易溶于水的气体,实验室制备及性质探究装置如图所示。回答下列问题:
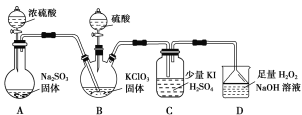
(1)装置B用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为___________。装置C中滴有几滴淀粉溶液,反应时有蓝色岀现。淀粉的作用是______。
(2)装置C的导管靠近而不接触液面,其目的是________。
(3)用ClO2消毒自来水,其效果是同质量氯气的______倍(保留一位小数)。
(4)装置D用于吸收尾气,若反应的氧化产物是一种单质,且氧化剂与氧化产物的物质的量之比是2∶1,则还原产物的化学式是___________。
(5)若将装置C中的溶液改为Na2S溶液,通入ClO2后溶液无明显现象。由此可以产生两种假设:
假设a:ClO2与Na2S不反应。
假设b:ClO2与Na2S反应。
①你认为哪种假设正确,阐述原因:___________。
②请设计实验证明你的假设(仅用离子方程式表示):__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com