
科目: 来源: 题型:
【题目】工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
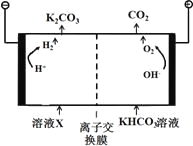
(1)在阳极区发生的反应包括_____________和H ++ HCO3-=H2O + CO2↑。
(2)简述CO32-在阴极区再生的原理_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20 mL 0.1mol/L醋酸溶液中滴加0.1 mol/L的氢氧化钠溶液,测定结果如下图所示。下列解释不正确的是

A. 0.1mol/L醋酸溶液pH约为3,说明醋酸是弱电解质
B. m大于20
C. a点表示的溶液中,c(CH3COO— )>c(Na+)
D. b点表示的溶液中,溶质为醋酸钠和氢氧化钠
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,0.1mol·L-1的H2A溶液中各种微粒浓度的对数值(lgc)与pH的关系如图所示。
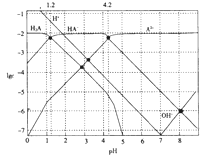
下列说法不正确的是
A. H2A是二元弱酸
B. HA-![]() H++A2-的电离平衡常数Ka=10-12
H++A2-的电离平衡常数Ka=10-12
C. 0.1mol·L-1的H2A溶液中:c(H+)=c(HA-)+2c(A2-)+c(OH-)
D. pH=4.2 时:c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
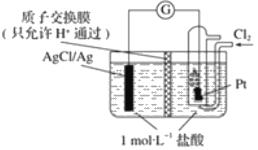
【题目】某原电池装置如图所示,电池总反应为 2Ag+Cl2═2AgCl。
(1)写出该电池工作时的两极反应:负极:___;正极:___。
(2)当电路中转移amole﹣时,交换膜左侧溶液中约减少___mol离子;交换膜右侧溶液c(HCl)___(填“>”“<”或“=”)1molL-1(忽略溶液体积变化)。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)在25℃、101Kpa下,1gCH3OH(l)燃烧生成CO2(g)和H2O(l)时放热22.68kJ。则CH3OH燃烧的热化学方程式为__________________。
(2)若以(1)中反应原理设计成甲醇燃料电池,电解质溶液为20%~30%的 KOH溶液,则该燃料电池的负极电极反应式为___________________。
(3)惰性电极电解400mL2mol/LCuSO4溶液,一段时间阴极增重1.28g (该极无气体放出),电解后溶液体积不变,则溶液的pH 为_____,阳极可收集标况下气体____mL。写出电解的离子方程式:_____
(4)某温度下,反应2NH3(g)![]() N2(g)+3H2(g)于恒容密闭容器中达到平衡状态。(填“正向”、“逆向”或“不”)。若某时刻向该容器内通入一定量氨气,则化学平衡________移动。若某时刻容器内所有物质的浓度均增加为原来的2倍,则化学平衡________移动。
N2(g)+3H2(g)于恒容密闭容器中达到平衡状态。(填“正向”、“逆向”或“不”)。若某时刻向该容器内通入一定量氨气,则化学平衡________移动。若某时刻容器内所有物质的浓度均增加为原来的2倍,则化学平衡________移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】水溶液中的行为是中学化学的重要内容,按要求回答下列问题.
(1)在醋酸水溶液中存在平衡CH3COOH![]() CH3COO-+H+若分别改变下列条件:①加水稀释②加热③加少量固体醋酸钠,其中能使醋酸电离程度增大的是_______,能使溶液pH增大的是_______(填序号)。
CH3COO-+H+若分别改变下列条件:①加水稀释②加热③加少量固体醋酸钠,其中能使醋酸电离程度增大的是_______,能使溶液pH增大的是_______(填序号)。
(2)常温下,0.1mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、CO32-、OH-四种微粒的浓度由大到小的顺序为:________________________________。
(3)AlCl3溶液加热蒸干并灼烧最终得到物质是________(填化学式),将NaHCO3与Al2(SO4)3溶液混合后可做泡沫灭火剂,其原理是_______(用离子方程式表示)。
(4)已知下列物质在20℃下的Ksp如下:
化学式 | AgCl | AgBr | AgI |
颜色 | 白色 | 浅黄色 | 黄色 |
Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 |
①当向含相同浓度Cl-、Br-、I-的溶液中滴加AgNO3溶液时,_______先沉淀(填离子符号),
②向BaCl2溶液中加入AgNO3和KBr,当两种淀共存时,  =__________。
=__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧化铈[Ce(OH)4]是一种重要的稀土氢氧化物。平板电视显示屏生产过程中会产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2),某课题组以此粉末为原料回收铈,设计实验流程如下:
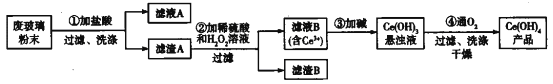
下列说法错误的是
A. 滤渣A中主要含有SiO2、CeO2
B. 过滤操作中用到的玻璃仪器有烧杯、漏斗、玻璃棒
C. 过程②中发生反应的离子方程式为CeO2+H2O2+3H+=Ce3++2H2O+O2↑
D. 过程④中消耗 11.2L O2(已折合成标准状况),转移电子数为2×6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在水溶液中1 mol Cl-、ClOx- (x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是 ( )
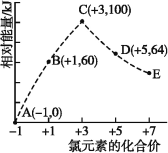
A.这些离子中结合H+能力最强的是A
B.A、B、C、D、E五种微粒中C最稳定
C.C→B+D的反应,反应物的总键能小于生成物的总键能
D.B→A+D反应的热化学方程式为3ClO-(aq)=ClO3- (aq)+2Cl-(aq) ΔH=+116 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,现有![]() 的
的![]() 溶液,
溶液,![]() 已知含氮
已知含氮![]() 或含碳
或含碳![]() 各微粒的分布分数
各微粒的分布分数![]() 平衡时某种微粒的浓度占各种微粒浓度之和的分数
平衡时某种微粒的浓度占各种微粒浓度之和的分数![]() 与pH的关系如图所示.下列说法正确的是
与pH的关系如图所示.下列说法正确的是![]()
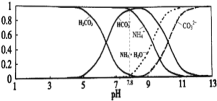
A.当溶液的![]() 时,溶液中存在下列关系:
时,溶液中存在下列关系:![]()
B.![]() 溶液中存在下列守恒关系:
溶液中存在下列守恒关系:![]()
C.往该溶液中逐滴滴加氢氧化钠时![]() 和
和![]() 浓度逐渐减小
浓度逐渐减小
D.通过分析可知常温下![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
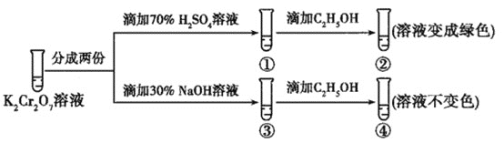
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com