
科目: 来源: 题型:
【题目】(1)完成下列反应的化学方程式:(注明反应的条件,并配平方程式)
①实验室制乙炔____;
②向苯酚钠溶液中通入少量的二氧化碳气体____;
③甲苯与氯气在光照条件下反应生成一氯取代产物____;
(2)有机物A的结构简式为CH3CH2CH(CH3)CH(CH3)C(CH3)3
①若A是单烯烃与氢气加成后的产物,则该单烯烃可能有____种结构(不考虑立体异构);
②若A是炔烃与氢气加成后的产物,则该单烯烃可能有____种结构;
③C5H12O的同分异构体中属于醇类且能被氧化成醛的有____种。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法,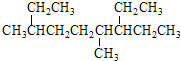 的名称为3,6-二甲基-7-乙基壬烷
的名称为3,6-二甲基-7-乙基壬烷
B.![]() 分子中所有原子共平面
分子中所有原子共平面
C.标准状况下,1L辛烷完全燃烧生成CO2 8L
D.1.0mol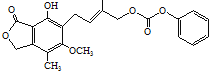 最多能与5.0molNaOH水溶液完全反应
最多能与5.0molNaOH水溶液完全反应
查看答案和解析>>
科目: 来源: 题型:
【题目】CuSO4是一种重要的化工原料,有关制备途径及性质如下图所示。下列说法错误的是( )

A.途径①所用混酸中H2SO4与HNO3的最佳物质的量之比为3:2
B.与途径①、③相比,途径②更好地体现了绿色化学思想
C.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量①=②<③
D.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol
查看答案和解析>>
科目: 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式__________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:
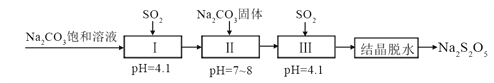
①pH=4.1时,Ⅰ中为__________溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是__________。
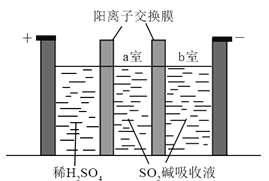
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为_____________。电解后,__________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。
(4)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000 mol·L1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为_____________,该样品中Na2S2O5的残留量为____________g·L1(以SO2计)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物的键线式如图所示,下列关于该有机物的描述不正确的是
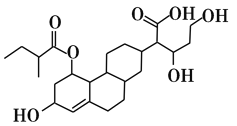
A.含有4种官能团
B.能发生取代、加成、酯化、氧化、还原等反应
C.1mol该物质最多可与3molH2发生加成反应
D.该有机物与Na、NaOH、Na2CO3均能反应
查看答案和解析>>
科目: 来源: 题型:
【题目】反应①Fe(s)+CO2(g) ![]() FeO(s)+CO(g) △H1=a kJ/mol;
FeO(s)+CO(g) △H1=a kJ/mol;
②CO(g)+1/2O2(g) ![]() CO2(g) △H2=b kJ/mol
CO2(g) △H2=b kJ/mol
测得在不同温度下,反应①的平衡常数 K 值随温度的变化如下:
![]()
(1)若 500℃时进行反应①,CO2起始浓度为 2 mol·L-1,CO2的平衡浓度为____________。
(2)反应①中的 a_____________0(填“大于”“小于”或“等于”)。
(3)700℃反应已经①达到平衡,要使该平衡正向移动,其他条件不变时,可以采取的措施有_____________(填序号)
A.缩小反应器体积 B.通入 CO2
C.升高温度到 900℃ D.使用合适的催化剂
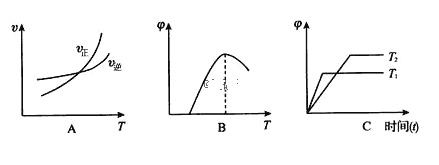
(4)下列图像符合反应①的是_____(填序号)(图中 v是速率、Φ为混合物中 CO2含量, T 为温度且 T1> T2)
(5) 2Fe(s)+O2(g) ![]() 2FeO(s) △H3,该反应的△H3= ________kJ/mol。(用含 a、b的代数式表示)
2FeO(s) △H3,该反应的△H3= ________kJ/mol。(用含 a、b的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
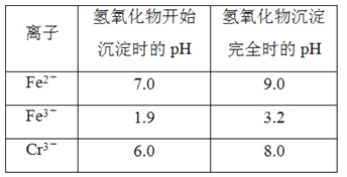
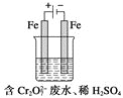
【题目】欲降低废水中重金属元素铬的毒性,可将Cr2O![]() 转化为Cr(OH)3沉淀除去。已知该条件下:
转化为Cr(OH)3沉淀除去。已知该条件下:
(1)某含铬废水处理的主要流程如图所示:
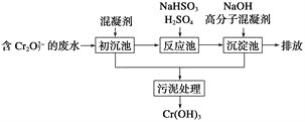
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·2H2O,其作用为(用离子方程式表示)____。
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+===2Cr3++3SO42-+4H2O。根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是_____、____。证明Cr3+沉淀完全的方法是____。
(2)工业可用电解法来处理含Cr2O![]() 废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加的铁粉的物质的量(横坐标)的关系如图所示,AB段与BC段所需Fe的质量比为( )
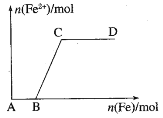
A.2:1B.1:2C.1:4D.3:8
查看答案和解析>>
科目: 来源: 题型:
【题目】目前全世界的镍(Ni)消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。
碱式碳酸镍的制备:
工业用电解镍新液(主要含NiSO4,NiCl2等)制备碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O],制备流程如图:
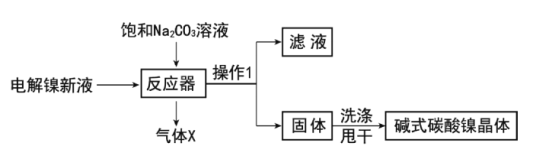
(1)反应器中的一个重要反应为3NiSO4+3Na2CO3+2H2O=NiCO3·2Ni(OH)2+3Na2SO4+2X,X的化学式为__。
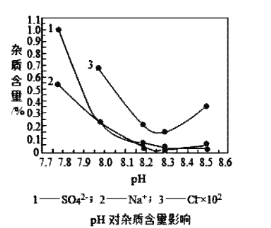
(2)物料在反应器中反应时需要控制反应温度和pH值。分析如图,反应器中最适合的pH值为__。
(3)检验碱式碳酸镍晶体洗涤干净的方法是__。
测定碱式碳酸镍晶体的组成:
为测定碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]组成,某小组设计了如图实验方案及装置:
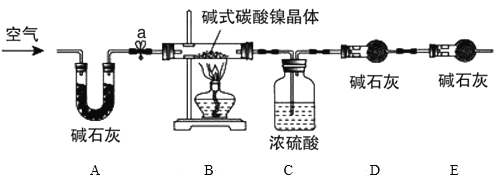
资料卡片:碱式碳酸镍晶体受热会完全分解生成NiO、CO2和H2O
实验步骤:
①检查装置气密性;
②准确称量3.77g碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]放在B装置中,连接仪器;
③打开弹簧夹a,鼓入一段时间空气,分别称量装置C、D、E的质量并记录;
④__;
⑤打开弹簧夹a缓缓鼓入一段时间空气;
⑥分别准确称量装置C、D、E的质量并记录;
⑦根据数据进行计算(相关数据如下表)
装置C/g | 装置D/g | 装置E/g | |
加热前 | 250.00 | 190.00 | 190.00 |
加热后 | 251.08 | 190.44 | 190.00 |
实验分析及数据处理:
(4)E装置的作用__。
(5)补充④的实验操作___。
(6)通过计算得到碱式碳酸镍晶体的组成__(填化学式)。
镍的制备:
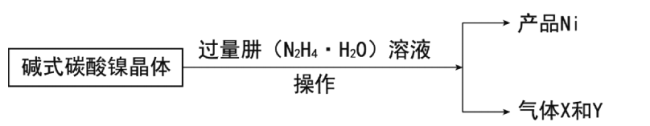
(7)写出制备Ni的化学方程式__。
查看答案和解析>>
科目: 来源: 题型:
【题目】芳樟醇和橙花叔醇是决定茶叶花甜香的关键物质。芳樟醇和橙花叔醇的结构如图所示,下列有关叙述正确的是

A. 橙花叔醇的分子式为C15H28O
B. 芳樟醇和橙花叔醇互为同分异构体
C. 芳樟醇和橙花叔醇与H2完全加成后的产物互为同系物
D. 二者均能发生取代反应、加成反应、还原反应,但不能发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com