
科目: 来源: 题型:
【题目】在一个固定容积的密闭容器中,可逆反应:mA(g)+nB(g) ![]() pC(g)+qD(g)中,当m、n、p、q为任意正整数时,达到平衡的标志是( )
pC(g)+qD(g)中,当m、n、p、q为任意正整数时,达到平衡的标志是( )
A.体系压强不再发生变化
B.各组分的物质的量浓度不再改变
C.各组分的质量分数相等
D.反应速率vA∶vB∶vC∶vD=m∶m∶p∶q
查看答案和解析>>
科目: 来源: 题型:
【题目】国际奥委会公布的违禁药物有138种,其中某种兴奋剂分子结构如图,关于它的说法正确的是( )

A. 该物质属于芳香烃
B. 该分子中所有碳原子共面
C. 1mol该物质与氢氧化钠溶液完全反应,最多消耗2molNaOH
D. 该物质的化学式为C15H24ClNO2
查看答案和解析>>
科目: 来源: 题型:
【题目】硫化碱法是工业上制备Na2S2O3的方法之一,反应原理:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应ΔH>0),某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下:

(1)吸硫装置如图所示:

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是____________,表明SO2吸收效率低的实验现象是B中_________。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是________、________。(写出两条)
(2)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取ag KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为VmL。则c(Na2S2O3)=_________ mol·L-1。(只列出算式,不作运算)已知:![]() +I2=
+I2=![]() +2I-
+2I-
(3)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能 ____(填“无影响”、“偏低”或“偏高”),原因是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将AgNO3溶液分别滴加到浓度均为0.01mol/L的NaBr、Na2SeO3溶液中,所得的沉淀溶解平衡曲线如图所示(Br-、SeO32-用Xn-表示,不考虑SeO32-的水解)。下列叙述正确的是

A. Ksp(Ag2SeO3)的数量级为10-10
B. d点对应的AgBr溶液为不饱和溶液
C. 所用AgNO3溶液的浓度为10-3 mol/L
D. Ag2SeO3(s)+2Br-(aq)==2AgBr(s)+SeO32- (aq)平衡常数为109.6,反应趋于完全
查看答案和解析>>
科目: 来源: 题型:
【题目】第23号元素钒在地壳中的含量大约为0.009%,在过渡元素中仅次于Fe、Ti、Mn、Zn,排第五位。我国四川攀枝花地区蕴藏着极其丰富的钒钛磁铁矿。
(1)钒在周期表中的位置为__________,电子占据的最高能层的轨道形状为__________。
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是__________。
(3)过渡金属可形成许多羰基配合物,即CO作为配体形成的配合物。
①CO的等电子体有N2、CN-、__________(任写一个)等。
②CO作配体时,配位原子是C而不是O,其原因是__________。
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。
①下列钒配合物中,钒原子满足18电子规则的是__________。
A.[V(H2O)6]2+ B.[V(CN)6]4- C.[V(CO)6]- D.[V(O2)4]3-
②化合物 的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“
的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“![]() ”中的大π键可表示为__________。
”中的大π键可表示为__________。
(5)VCl2(熔点1027 ℃)和VBr2(熔点827 ℃)均为六方晶胞,结构如图所示。

①VCl2和VBr2两者熔点差异的原因是__________。
②设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为__________(用含a、c、r+和r-的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中,一定条件下进行如下反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
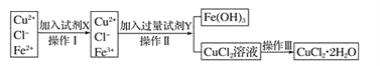
请参照下表给出的数据填空。

(1)操作I加入X的目的是___________________________ 。
(2)下列物质都可以作为X,适合本实验的X物质可以是_________(填字母)。
A KMnO4 B NaClO C H2O2 D Cl2
(3)操作II的Y试剂为____________(填化学式),并调节溶液的pH在______范围。
(4)实验室在配制CuCl2溶液时需加入少许_________(填物质名称),理由是(文字叙述并用有关离子方程式表示)__________________________________________。
(5)若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物H是一种邮寄材料中间体。实验室由芳香烃A制备H的一种合成路线如下:
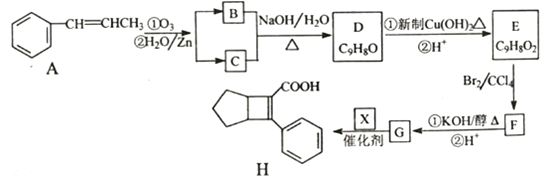
已知:①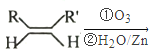 RCHO+RCHO
RCHO+RCHO
②RCHO+RCH2CHO![]() +H2O
+H2O
③![]()
请回答下列问题:
(1)芳香化合物B的名称为_________,C的同系物中相对分子质量最小的结构简式为__________。
(2)由E生成F的反应类型为_________。
(3)X的结构简式为_________。
(4)写出D生成E的第①步反应的化学方程式_______________。
(5)G与乙醇发生酯化反应生成化合物Y,Y有多种同分异构体,其中符合下列条件的同分异构体有____种,写出其中任意一种的结构简式________。
①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2;
②其核磁共振氢谱显示有4种不同化学键环境的氢,且峰面积之比为6:2:1:1。
(6)写出用![]() 为原料制备化合物
为原料制备化合物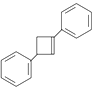 的合成路线,其他无机试剂任选。________
的合成路线,其他无机试剂任选。________
查看答案和解析>>
科目: 来源: 题型:
【题目】三元锂电池是以镍、钴、锰为正极材料的新型电池,镍、钴、锰材料可表示为Li1-nNixCoyMnzO2,x+y+z=1,通常简写为Li1-n MO2,Ni、Co、 Mn 三种元素分别显+2、+3、+4价。其充电时总反应为:LiMO2 +C6![]() Li1-nMO2+LinC6,下列说法错误的是
Li1-nMO2+LinC6,下列说法错误的是
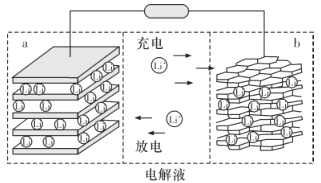
A.放电时电子从b电极由导线移向a电极
B.在Li1-nMO2材料中,若x:y:z=2:3:5,则n=0.3
C.放电时,正极反应为:Li1- nMO2+nLi++ne - =LiMO2
D.充电时,当转移0.2mol电子,负极材料减重1.4 g
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
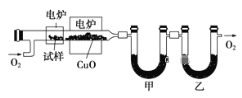
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收.2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水;
步骤二:通过仪器分析得知X的相对分子质量为106;
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2∶3 (如图Ⅰ)
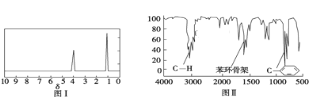
步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ,试回答:
(1)步骤二中的仪器分析方法称为___________。
(2)X的分子式为___________;(写出计算过程)X的结构简式为___________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com