
科目: 来源: 题型:
【题目】(15 分)化合物H 是合成药物盐酸沙格雷酯的重要中间体,其合成路线如下:
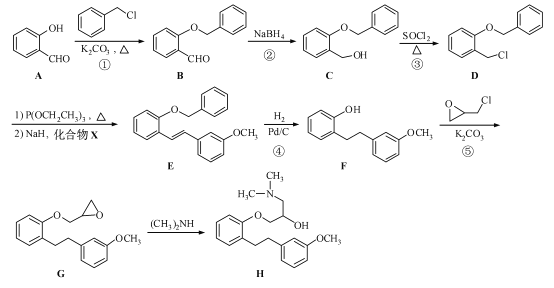
(1)化合物A 中的含氧官能团为 和 (填官能团名称)。
(2)反应①→⑤中,属于取代反应的是 (填序号)。
(3)写出同时满足下列条件的B 的一种同分异构体的结构简式: 。
I. 分子中含有两个苯环;II. 分子中有7 种不同化学环境的氢;III. 不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应。
(4)实现D→E 的转化中,加入的化合物X 能发生银镜反应,X 的结构简式为 。
(5)已知:![]() 。化合物
。化合物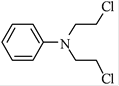 是合成抗癌药物美法伦的中间体,请写出以
是合成抗癌药物美法伦的中间体,请写出以![]() 和
和![]() 为原料制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下的恒温恒容密闭容器中发生反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L。则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L。则下列判断正确的是
A. c1:c2=1:2 B. 平衡时,Y和Z的生成速率之比为2:3
C. 若反应正向进行,X、Y的转化率不相等 D. c1的取值范围为0<c1<0.14mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
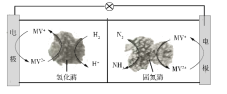
A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目: 来源: 题型:
【题目】星形聚合物SPLA可经下列反应路线得到(部分反应条件未注明)。
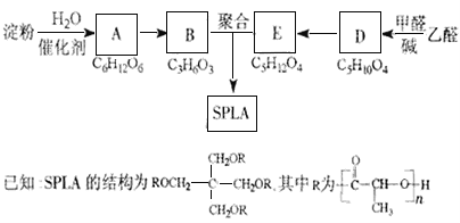
(1)淀粉是____________糖(填“单”或“多”);A的名称是_______。
(2)乙醛由不饱和烃制备的方法之一是_______________________(用化学方程式表示,可多步)。
(3)D![]() E的化学反应类型属于_________反应;D结构中有3个相同的基团,且1mol D能与2mol Ag(NH3)2OH反应,则D的结构简式是______;D与银氨溶液反应的化学方程式为____________________________。
E的化学反应类型属于_________反应;D结构中有3个相同的基团,且1mol D能与2mol Ag(NH3)2OH反应,则D的结构简式是______;D与银氨溶液反应的化学方程式为____________________________。
(4)B的直链同分异构体G的分子中不含甲基,G既不能与NaHCO3溶液反应,又不能与新制Cu(OH)2反应,且1mol G与足量Na反应生成1mol H2,则G的结构简式为______。
(5)B有多种脱水产物,其中两种产物的结构简式为______和______。
查看答案和解析>>
科目: 来源: 题型:
【题目】过碳酸钠![]() 是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如图1:
是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如图1:

已知:主反应![]()
![]()
![]()
![]()
副反应![]()
滴定反应:
![]() ,
,![]() 时
时![]() 开始分解。
开始分解。
请回答下列问题:
(1)图2中支管的作用是 ______ 。
(2)步骤![]() 的关键是控制温度,其措施有 ______ 和 ______ 。
的关键是控制温度,其措施有 ______ 和 ______ 。
(3)在滤液X中加入适量NaCl固体或无水乙醇,均可析出过碳酸钠,原因是 ______ 。
(4)步骤![]() 中选用无水乙醇洗涤产品的目的是 ______ 。
中选用无水乙醇洗涤产品的目的是 ______ 。
(5)下列物质中,加入到过碳酸钠溶液中,不会产生大量气体的是 ______ 。
A.MnO2 B.FeCl3 C.Na2SO3 D.NaOH E.HCl
(6)准确称取![]() 过碳酸钠于250mL 锥形瓶中,加50mL 蒸馏水溶解,再加50mL
过碳酸钠于250mL 锥形瓶中,加50mL 蒸馏水溶解,再加50mL![]()
![]() ,用
,用![]()
![]()
![]() 标准溶液滴定至终点时消耗
标准溶液滴定至终点时消耗![]() ,则产品中
,则产品中![]() 的质量分数为 ______ 。
的质量分数为 ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒。某学习小组针对亚硝酸钠设计了如下实验:
【制取NaNO2】
设计的制取装置如下图(夹持装置略去):

该小组先查阅资料知:①2NO+Na2O2 =2NaNO2;2NO2+Na2O2 =2NaNO3;
②NO能被酸性高锰酸钾氧化为NO3-,
(1)装置A中用于盛放稀硝酸的仪器名称为_______________,装置A中发生主要反应的离子方程式为_____________________________。
(2)装置D的作用是_____________________________。
(3)若无装置B,则进入装置D中的气体除N2、NO外还可能有_____________________________。
(4)甲同学检查装置气密性后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。下列可以提高NaNO2纯度的方案是____________(填字母)。
a.将B中的药品换为碱石灰 b.将稀硝酸换为浓硝酸
C.实验开始前通一段时间CO2 d.在装置A、B之间增加盛有水的洗气瓶
【测定制得样品中NaNO2的含量】
(5)该实验中需配制KMnO4标准溶液并酸化,应选择_______(填化学式)来酸化KMnO4溶液。
(6)已知:在酸性溶液中,NO2-可将MnO4-还原为Mn2+。为测定样品中亚硝酸钠的含量,该小组称取4.0 g样品溶于水配制成250 mL溶液,取25.00 mL溶液于锥形瓶中,用0.100 mol·L-1的酸性KMnO4 溶液进行滴定,消耗20.00 mL酸性KMnO4溶液。滴定过程中酸性KMnO4溶液的作用是_______________,所得样品中NaNO2的质量分数为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目: 来源: 题型:
【题目】浙江大学成功研制出能在数分钟之内将电量充满的Li-SOCl2电池,该电池是迄今具有最高能量比的电池其成本只有传统锂电池的一半。若电解液为LiAlCl4﹣SOCl2,电池的总反应为:4Li+2SOCl2![]() 4LiCl+S+SO2。下列说法不正确的是( )
4LiCl+S+SO2。下列说法不正确的是( )
A.放电时,负极反应式为:Li – e- = Li+
B.若用该电池作为外接电源电镀铜,当阴极质量增加64 g时,理论上将消耗14g Li
C.放电时,电解液中Li+向负极迁移
D.充电时,阳极反应式为:4Cl﹣+S+SO2﹣4e﹣=2SOCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化。某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3。

(1)实验开始的步骤,组装好仪器,____________,按图示加入试剂,关闭K1打开K2,先向C中烧瓶加入Na2S和 Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(2)C中的烧瓶发生如下反应:2Na2S+ Na2CO3+4SO2=3Na2S2O3+CO2,反应开始后,C中先有浑浊产生,后又变澄清,此浑浊物是________;为了保证Na2S2O3的产量,实验中通入C的SO2不能过量,用离子方程式表示其原因_________。
(3)该实验制得的产品中含有NaSO4杂质,为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验开始的步骤进行了改进,改进后的操作是__________。
(4)B装置可以起到安全瓶,防止倒吸的作用,另外在实验结束后拆除装置时还可以防止污染空气,具体操作方法是____________。
(5)制取Na2S2O3的另一种方法是直接将硫粉和亚硫酸钠,数混合共热制取。为探究制取硫代硫酸钠最佳条件,设计如下对比实验(每次实验时亚硫酸钠质量均为63g,反应时间为30min):
实验序号 | 溶液pH | 亚硫酸钠与水的质量比 | 反应温度 | 硫粉质量 | 亚硫酸钠转化率 |
1 | 10 | 1.5:1 | 100℃ | 18 | 80.7% |
2 | 10 | 1.1:1 | 100℃ | 18 | 94.6% |
①实验1、2的目的是探究_________对亚硫酸钠转化率的影响;
②若要完成上表中列出的各项条件对亚硫酸钠转化率的影响探究,除实验1、2外,至少还需进行____次对比实验;
③实验表明:亚硫酸钠转化率不受硫粉质量多少的影响.原因为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com