
科目: 来源: 题型:
【题目】已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸 | CH3COOH | H2CO3 |
电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则c(CH3COOH)/c(CH3COO-)=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E是由上述四种元素中的一种或几种组成的物质。已知A、B分子中分别含有18、10个电子,E为单质,D有漂白性。五种物质间的转化关系如图所示。下列说法错误的是( )
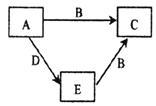
A.四种元素简单离子半径比较:W>Y>Z>X
B.Y的氢化物与Y的最高价氧化物的水化物反应生成盐
C.X、Y、W组成的化合物中一定既有离子键又有极性键
D.W是所在周期中原子半径最小的元素
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)![]() 2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是

A. a、b、c三个状态只有b是平衡状态
B. 达到平衡时A2的转化率大小为:b>a>c
C. 若T2<T1,则正反应一定是吸热反应
D. b点时,平衡体系中A、B原子数之比接近1∶3
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程:
。
(2)联氨(N2H4)是一种还原剂。已知:H2O(l)=H2O(g) △H=+44kJ/mol。试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式: 。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)KCN可用于溶解难溶金属卤化物。将AgI溶于KCN溶液中,形成稳定的Ag(CN)2—,该转化的离子方程式为: 。若已知Ksp(AgI)=1.5×10—16,K稳[Ag(CN)2—]=1.0×10-21,则上述转化方程式的平衡常数K= 。(提示:K稳越大,表示该化合物越稳定)
(4)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式: 。
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]()
![]() N2O4其相关图像如下。
N2O4其相关图像如下。
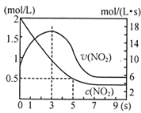
①0~3s时v(NO2)增大的原因是 。
②5s时NO2转化率为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用太阳能光伏电池电解水可交替制得高纯H2和O2,工作示意图如图所示。下列说法错误的是( )
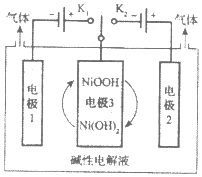
A.制H2时,连接K1;制O2时,连接K2
B.产生H2的电极反应式是2H++2e-=H2↑
C.制O2时电极3发生的电极反应为NiOOH+H2O+e-=Ni(OH)2+OH-
D.通过控制开关交替连接K1或K2,可以使电极3循环使用
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.20gD2O含有的中子数为10NA
B.1L0.1mo1L-1亚硫酸钠溶液含有的SO32-数目为0.1NA
C.1molKMnO4被还原为Mn2+转移的电子数为5NA
D.16gO2和32gO3的混合物中所含原子数为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程:
。
(2)联氨(N2H4)是一种还原剂。已知:H2O(l)=H2O(g) △H=+44kJ/mol。试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式: 。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)KCN可用于溶解难溶金属卤化物。将AgI溶于KCN溶液中,形成稳定的Ag(CN)2—,该转化的离子方程式为: 。若已知Ksp(AgI)=1.5×10—16,K稳[Ag(CN)2—]=1.0×10-21,则上述转化方程式的平衡常数K= 。(提示:K稳越大,表示该化合物越稳定)
(4)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式: 。
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]()
![]() N2O4其相关图像如下。
N2O4其相关图像如下。

①0~3s时v(NO2)增大的原因是 。
②5s时NO2转化率为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中,反应![]() 达到平衡时,测得
达到平衡时,测得![]() 为
为![]() 在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得
在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得![]() 为
为![]() 下列判断中不正确的是
下列判断中不正确的是
A.物质B的质量分数减小B.平衡时逆反应速率减小
C.化学计量数:![]() D.物质C的体积分数不变
D.物质C的体积分数不变
查看答案和解析>>
科目: 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
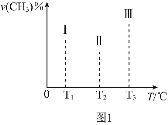
I.(1)已知:一定条件下![]() 可被甲烷还原“纳米级”的金属铁。其反应为:
可被甲烷还原“纳米级”的金属铁。其反应为:
![]()
①此反应的化学平衡常数表达式为______
②在容积均为VL的I、II、III三个相同密闭容器中加入足量![]() ,然后分别充入amol
,然后分别充入amol![]() ,三个容器的反应温度分别为
,三个容器的反应温度分别为![]() 、
、![]() 、
、![]() 且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时
且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时![]() 的体积分数如图1所示,此时I、II、III三个容器中一定处于化学平衡状态的是______;上述反应的
的体积分数如图1所示,此时I、II、III三个容器中一定处于化学平衡状态的是______;上述反应的![]() ______
______![]() 填“大于”或“小于”
填“大于”或“小于”![]() ,该反应在______
,该反应在______![]() 填“高温”、“低温”或“任意温度”
填“高温”、“低温”或“任意温度”![]() 下可自发进行。
下可自发进行。
![]() 利用天然气为原料的一种工业合成氨简式流程图如图2:
利用天然气为原料的一种工业合成氨简式流程图如图2:
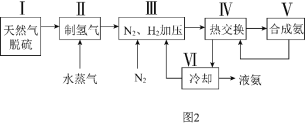
(1)步骤Ⅱ中制氢气的原理如下:Ⅰ![]() ;
;![]()
Ⅱ![]() ;
;![]()
①对于反应Ⅰ,在一定温度下的恒容容器中,表示其已达到最大化学反应限度的叙述正确的是______。
A.单位时间内1mol![]() 消耗,同时有3mol
消耗,同时有3mol![]() 生成;
生成;
B.![]() 、
、![]() 、CO的物质的量浓度相等;
、CO的物质的量浓度相等;
C.混合气体的密度再改变;
D.混合气体的压强不再改变。
②则反应![]() ;
;![]() ______
______![]() 用含
用含![]() 、
、![]() 的代数式表示
的代数式表示![]() 。
。
(2)合成氨是人类科学技术上的一项重大突破,反应原理为:![]() 在容积为10L的密闭容器中进行,起始时充入
在容积为10L的密闭容器中进行,起始时充入![]()
![]() 、
、![]()
![]() 反应在不同条件下进行,反应体系总压强随时间的变化如图3所示。
反应在不同条件下进行,反应体系总压强随时间的变化如图3所示。
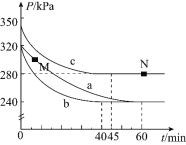
①实验a从开始至平衡时的反应速率![]() ______;实验c中
______;实验c中![]() 的平衡转化率
的平衡转化率![]() 为______。
为______。
②与实验a相比,其他两组改变的实验条件是:b______,c______。
③M点的逆反应速率![]() ______N点的正反应速率
______N点的正反应速率![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ;N点时再加入一定量
;N点时再加入一定量![]() ,平衡后
,平衡后![]() 的体积分数______
的体积分数______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要意义,对于密闭容器中的反应:![]()
(1)写出该反应的逆反应的化学平衡常数表达式______,升高温度,该反应化学反应速率______,氢气的转化率______![]() 以上均填“增大”、“减小”或“不变”
以上均填“增大”、“减小”或“不变”![]() 。实际生产中温度一般控制在
。实际生产中温度一般控制在![]() ,原因是______。
,原因是______。
(2)能表示该反应在恒温恒容密闭容器中![]() 时刻后已经达到平衡状态的图示是______。
时刻后已经达到平衡状态的图示是______。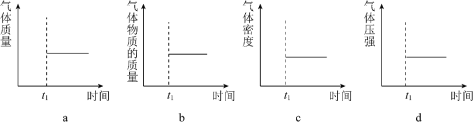
(3)浓度![]() 的氨水,pH为
的氨水,pH为![]() 当用蒸馏水稀释100倍时,则
当用蒸馏水稀释100倍时,则![]() 的电离平衡将向______方向移动
的电离平衡将向______方向移动![]() 填“正”或“逆”
填“正”或“逆”![]() ,溶液的pH将为______
,溶液的pH将为______![]() “大于”“小于”“等于”
“大于”“小于”“等于”![]() 。
。
设计一个简单实验,证明一水合氨是弱碱:______。
某化学兴趣小组进行了下列关于氯化铵的课外实验:
(实验操作)
![]()
浸过氯化钠溶液的布条很快烧光,浸过氯化铵溶液的布条不燃烧,冒出白烟。
(4)氯化铵饱和溶液中离子浓度由大到小的顺序是______。白烟的成分是______。
(5)请推测浸过氯化铵溶液的布条不燃烧、不易着火的主要原因![]() 写出一条即可
写出一条即可![]() ______
______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com