
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.20gD2O含有的中子数为10NA
B.1L0.1mo1L-1亚硫酸钠溶液含有的SO32-数目为0.1NA
C.1molKMnO4被还原为Mn2+转移的电子数为5NA
D.16gO2和32gO3的混合物中所含原子数为3NA
科目:高中化学 来源: 题型:
【题目】NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为_________________________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A 铁 B 铝 C 铂 D 玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是____________________(填化学方程式)。
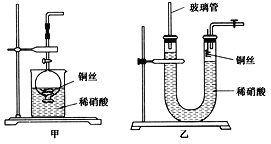
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是_____________________________________________________。
②让反应停止的操作方法及原因是________________________________________。
(4)以下收集NO气体的装置,
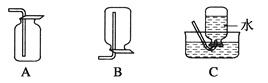
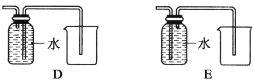
合理的是________(填选项代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取硝酸铵的流程图如下,请回答下列问题:
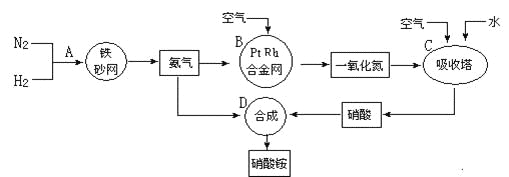
(1)在上述工业制硝酸的生产中,B设备的名称是_____________,其中发生反应的化学方程式为________________________________________________。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是______________。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
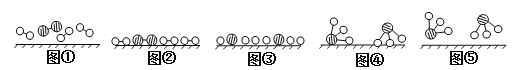
![]() 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是________________、____________________。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是________________、____________________。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是_____________________;在合成硝酸的吸收塔中通入空气的目的是______________________________。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2![]() 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是________________________________。
(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。利用处理后的废旧锂离子电池材料(主要成分为Co3O4,还含有少量铝箔、LiCoO2等杂质)制备CoO,工艺流程如图:
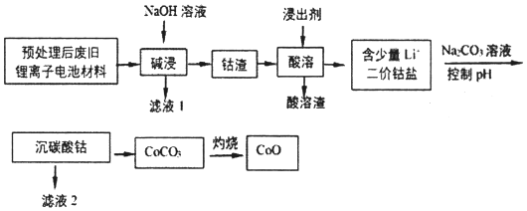
回答下列问题:
(1)Co元素在元素周期表中的位置___。
(2)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极回收的原因是___;提高“碱浸”效率的措施有____(至少写两种)。
(3)不同浸出剂“酸溶”结果如表:
出剂 | 浸出液化学成分/(gL-1) | 钴浸出率/% | |
Co | Al | ||
(a)HCl | 80.84 | 5.68 | 98.4 |
(b)H2SO4 | 65.0 | 6.22 | 72.3 |
(c)H2SO4+Na2S2O3 | 84.91 | 5.96 | 98.0 |
①浸出剂(a)的钴浸出率最高,而实际工艺中一般不选用浸出剂(a)的原因是____。
②温度越高浸出反应速率越快,所以“酸溶”一般选用较高的温度。据此你选择的浸出剂是___(填序号),理由是___。
③从氧化还原角度分析,还原等物质的量的Co3O4,需要___(填“H2O2”或“Na2S2O3”)物质的量更少。
④综上分析,写出最合适的浸出剂与Co3O4反应的化学方程式____。
(4)已知:Ksp[Co(OH)2]=1.0×10-15,Ksp(Li2CO3)=1.7×10-3,Ksp(CoCO3)=1.5×10-13。若滤液2中Co2+含量为5.9×10-2gL1,计算判断“沉碳酸钴”应调节pH不高于____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明![]() 溶液中存在水解平衡SO32-+H2OHSO3-+OH-的事实是
溶液中存在水解平衡SO32-+H2OHSO3-+OH-的事实是
A.滴入酚酞溶液变红,再加入![]() 溶液红色褪去
溶液红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,在加入![]() 溶液后产生沉淀且红色褪去
溶液后产生沉淀且红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸 | CH3COOH | H2CO3 |
电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则c(CH3COOH)/c(CH3COO-)=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组以重铬酸钾(K2Cr2O7)溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”。
已知:①K2Cr2O7溶液存在平衡:Cr2O![]() +H2O
+H2O![]() 2CrO
2CrO![]() +2H+。
+2H+。
②含铬元素的离子在溶液中的颜色:Cr2O![]() (橙色);CrO
(橙色);CrO![]() (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。

(1)i可证明反应Cr2O![]() +H2O
+H2O![]() 2CrO
2CrO![]() +2H+的正反应是__________(填“吸热”或“放热”)。
+2H+的正反应是__________(填“吸热”或“放热”)。
(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是_________。
(3)iii的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的________(填“能”或“不能”),理由是____________。
(4)根据实验Ⅱ中不同现象,可以得出的结论是__________。
(5)继续实验

①解释溶液变黄的主要原因是________。
②溶液变绿色,该反应的离子方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2CO3溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HCO3-)+c( CO32-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁,可以将其变废为宝。将废弃的线路板粉碎,经处理后可以得到粗铜(75%Cu、20%Al、4%Fe及少量Au、Pt),进一步制取胆矾,流程简图如下:
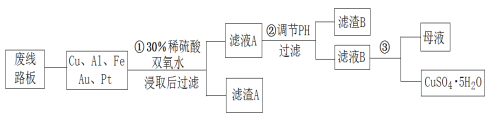
(1)滤渣A的成分主要是_____________。
(2)步骤①中溶解Cu的化学方程式是_________________,用______替代双氧水,加热,同样可以达到目的。
(3)步骤②调节溶液pH的目的是__________,可选用的最佳试剂是___。(写出一种即可)
(4)以石墨作电极电解滤液B,电解方程式是___________________。
(5)对以上粗铜进行电解精炼,下列说法正确的是_________。
A.电能全部转化为化学能
B.粗铜接电源正极,发生氧化反应
C.溶液中Cu2+的浓度保持不变
D.阳极泥中可回收Pt、Au等金属
(6)取128Kg粗铜利用上述流程制得CuSO4·5H2O的质量为326.25Kg,则CuSO4·5H2O的产率为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com