
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2CO3溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HCO3-)+c( CO32-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
【答案】D
【解析】
根据题中离子浓度关系可知,本题考查离子浓度大小的比较、弱电解质在水溶液中的电离平衡、盐类水解的应用,运用电离平衡、盐类水解知识分析。
A.H2S为二元弱酸,分步电离,H2S溶液中,存在H2S![]() H++HS-、HS-
H++HS-、HS-![]() H++S2-、H2O
H++S2-、H2O![]() H++OH-,根据上述反应知,pH=5的H2S溶液中,c(H+)=1×10-5molL-1> c(HS-),A项错误;
H++OH-,根据上述反应知,pH=5的H2S溶液中,c(H+)=1×10-5molL-1> c(HS-),A项错误;
B.加水稀释促进氨水电离,pH=a的氨水溶液,稀释10倍后,溶液中的氢氧根离子浓度大于原来的![]() ,其pH=b,则a<b+1, B项错误;
,其pH=b,则a<b+1, B项错误;
C.H2CO3是二元弱酸,任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),C项错误;
D.酸性:CH3COOH>H2CO3>HClO,根据盐类水解规律:组成盐的酸根离子对应的酸越弱,该盐的水解程度越大,物质的量浓度相同时,溶液的碱性越强,则pH越大,故pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的浓度由大到小为①>②>③,即c(Na+)大小为:①>②>③,D项正确;
答案选D。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是肉制品生产中最常使用的一种食品添加剂,某化学兴趣小组利用一氧化氮与过氧化钠反应制备亚硝酸钠并进行一系列实验探究。
查阅资料:
①NO2能与Na2O2反应;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
Ⅰ.制备亚硝酸钠

(1)装置A用恒压滴液漏斗,相比普通分液漏斗,显著的优点是____________________________。
(2)上述装置按气流方向连接的顺序为:a→____________________(填仪器接口的字母编号)。
(3)D中反应的方程式为_____________________________。如果没有B装置,D中生成的亚硝酸钠中含有的杂质有______________(填化学式)。
(4)C装置的作用是_________________(用离子方程式表示)。
Ⅱ.测定产品纯度,实验步骤:
①准确称量4.000 g产品配成250 mL溶液。
②从步骤①配制的溶液中移取25.00 mL加入锥形瓶中。
③用0.1000 mol/L酸性KMnO4溶液滴定至终点。
④重复以上操作3次,消耗酸性KMnO4溶液的平均体积为20.00 mL。
(5)达到滴定终点的现象是____________。产品中NaNO2的纯度为______________%。
(6)设计实验证明HNO2的酸性比CH3COOH强_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.20gD2O含有的中子数为10NA
B.1L0.1mo1L-1亚硫酸钠溶液含有的SO32-数目为0.1NA
C.1molKMnO4被还原为Mn2+转移的电子数为5NA
D.16gO2和32gO3的混合物中所含原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为___,该元素的符号是___;
(2)Y元素原子的价层电子的电子排布图为___,该元素的名称是___;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为___;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组设计如下实验方案,测定NaHCO3和Na2CO3混合物中NaHCO3的质量分数。
方案一:按下图装置进行实验。并回答以下问题。
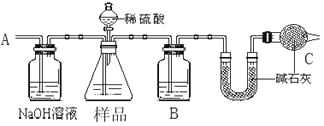
①按图组装仪器并检查装置的气密性。
②实验前称取17.90g样品,从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止, 从导管A处缓缓鼓入一定量的空气。
③实验结束后测得U型管增重 8.80g。
(1)B瓶中装的试剂为______,C装置的作用是__________________________。
(2)从导管A处缓缓鼓入一定量的空气的目的是_______________。
(3)该样品中NaHCO3的质量分数为_____________。
方案二:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量Ba(OH)2溶液。过滤洗涤,干燥沉淀,称量固体质量,进行有关计算。
请回答:实验中判断沉淀是否完全的方法是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气(CO+H2)可利用甲烷与水蒸气重整反应制得。
(1)已知:①H2(g)+![]() O2(g)=H2O(g) △H1=-242kJmol-1
O2(g)=H2O(g) △H1=-242kJmol-1
②2CO(g)+O2(g)=2CO2(g) △H2=-576kJmol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-802.6KJmo1-1
则甲烷和水蒸气重整反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H4=____。该反应的活化能E1=240.1kJmol-1,则逆反应的活化能E2=____。
CO(g)+3H2(g)△H4=____。该反应的活化能E1=240.1kJmol-1,则逆反应的活化能E2=____。
(2)重整反应中CH4的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图1所示。
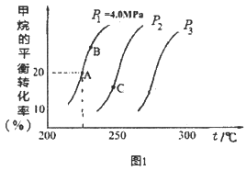
①图中A点的平衡常数KP=___(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),比较A、B、C三点的平衡常数Kp(A)、KP(B)、KP(C)由大到小的顺序为___。
②图中压强P1、P2、P3由大到小的顺序为___,理由是____。
(3)在恒容密闭容器中充入2mol的CH4和H2O(曲混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下测得H2平衡产率与x的关系如图2所示。请比较a、b两点CH4的转化率a点___b点(填“>”、“<”、“=”下同),a点c(CH4)___b点c[H2O(g)]。当x=1时,下列叙述正确的是____(填序号)。
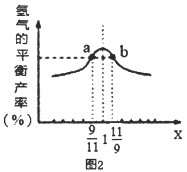
A.平衡常数K最大 B.CH4的转化率最大
C.氢气的产率最大 D.合成气的浓度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]铬元素在地壳中含量占第21位,是一种重要的金属。回答下列问题:
(1)基态铬原子的价电子排布式为_________________,根据价层电子判断铬元素中最高价态为___________价。铬元素的第二电离能________锰元素的第二电离能(填“>”“<”填“=”)。
(2)无水氯化亚铬(CrCl2)的制备方法为在500℃时用含HCl的H2气流还原CrCl3,该过程涉及到的反应原理为____________________________________________(用化学方程式表示)。
已知:氯化亚铬的熔点为820~824℃,则其晶体类型为___________晶体。二价铬还能与乙酸根形成配合物,在乙酸根中碳原子的杂化形式为___________
(3)已知CrO5中铬元素为最高价态,画出其结构式:______________________
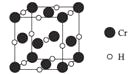
(4)Cr元素与H元素形成化合物的晶胞结构如图所示,则该化合物的化学式为___________。已知:该晶胞的边长为437.6 pm,NA表示阿伏加德罗常数的值,则晶体的密度为____g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]3H2O(三草酸合铁酸钾晶体)为翠绿色晶体,可用于摄影和蓝色印刷,110℃失去结晶水,230℃分解。某化学研究小组对K3[Fe(C2O4)3]3H2O受热分解生成的气体产物和固体产物进行探究。
实验一:探究实验所得的气体产物,按如图装置进行实验(夹持仪器已略去,部分装置可重复使用)。
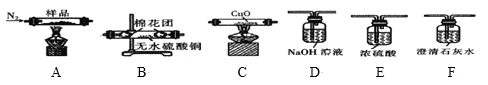
(1)实验室常用饱和NH4Cl和饱和NaNO2的混合液制N2,反应的化学方程式为__。
(2)装置的连接顺序为:A→__→__→__→__→__→F(填各装置的字母代号)。__
(3)检查装置气密性后,先通一段时间N2,其目的是__,实验结束时熄灭A、C两处的酒精灯,继续通N2至常温,其目的是__。
(4)实验过程中观察到F中的溶液变浑浊,C中有红色固体生成,则气体产物__(填化学式)。
实验二:分解产物中固体成分的探究
(5)定性实验:经检验,固体成分含有K2CO3、FeO、Fe。
定量实验:将固体产物加水溶解、过滤洗涤、干燥,得到含铁样品。完成上述实验操作,需要用到下列仪器中的___(填仪器编号)。

设计下列三种实验方案分别对该含铁样品进行含量的测定
甲方案:ag样品![]() 溶液
溶液![]() 得固体bg
得固体bg
乙方案:ag样品![]() 测得气体体积VmL(标况)
测得气体体积VmL(标况)
丙方案:ag样品![]() 250mL溶液
250mL溶液![]() 三次平均消耗0.1molL-1酸性KMnO4溶液VbmL
三次平均消耗0.1molL-1酸性KMnO4溶液VbmL
你认为以上方案中可以确定样品组成的有__方案。
(6)经测定产物中n(FeO):n(Fe)=1:1,写出K3[Fe(C2O4)3]3H2O分解的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示。下列有关叙述正确的是
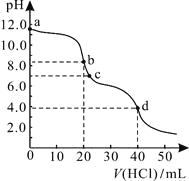
A. a点溶液呈碱性的原因用离子方程式表示为:CO![]() +2H2O
+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. c点处的溶液中c(Na+)-c(Cl-)=c(HCO![]() )+2c(CO
)+2c(CO![]() )
)
C. 滴定过程中使用甲基橙作为指示剂比酚酞更准确
D. d点处溶液中水电离出的c(H+)大于b点处
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com