
【题目】某校化学研究性学习小组设计如下实验方案,测定NaHCO3和Na2CO3混合物中NaHCO3的质量分数。
方案一:按下图装置进行实验。并回答以下问题。
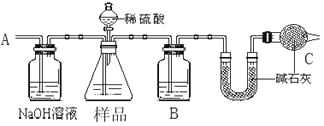
①按图组装仪器并检查装置的气密性。
②实验前称取17.90g样品,从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止, 从导管A处缓缓鼓入一定量的空气。
③实验结束后测得U型管增重 8.80g。
(1)B瓶中装的试剂为______,C装置的作用是__________________________。
(2)从导管A处缓缓鼓入一定量的空气的目的是_______________。
(3)该样品中NaHCO3的质量分数为_____________。
方案二:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量Ba(OH)2溶液。过滤洗涤,干燥沉淀,称量固体质量,进行有关计算。
请回答:实验中判断沉淀是否完全的方法是_____________________________________。
【答案】浓H2SO4 防止空气中水蒸气、CO2进入U型管被吸收 把反应产生的CO2全部导入U形管中 70.4% 取少量滤液,再滴加少许Ba(OH)2溶液,如无白色沉淀说明沉淀完全
【解析】
方案一:测定NaHCO3和Na2CO3混合物中NaHCO3的质量分数,由实验装置可知,从导管A处缓缓鼓入一定量的空气,先将装置中的二氧化碳排出,NaOH溶液可除去空气中的二氧化碳,锥形瓶中发生样品与硫酸的反应生成二氧化碳气体,B中应为浓硫酸干燥二氧化碳,U型管增重为反应生成二氧化碳的质量,干燥管中的碱石灰防止空气中的二氧化碳进入U型管中干扰含量的测定;
方案二:小烧杯中加入足量Ba(OH)2溶液,NaHCO3和Na2CO3均反应,生成沉淀为碳酸钡,向滤液中继续滴氢氧化钡观察是否生成沉淀判断是否沉淀完全。
方案一:测定NaHCO3和Na2CO3混合物中NaHCO3的质量分数,由实验装置可知,从导管A处缓缓鼓入一定量的空气,先将装置中的二氧化碳排出,NaOH溶液可除去空气中的二氧化碳,锥形瓶中发生样品与硫酸的反应生成二氧化碳气体,B中应为浓硫酸干燥二氧化碳,U型管增重为反应生成二氧化碳的质量,干燥管中的碱石灰防止空气中的二氧化碳进入U型管中干扰含量的测定,
(1)由上述分析可知B瓶中装的试剂为浓硫酸,C装置的作用是防止空气中水蒸气、CO2进入U型管被吸收,故答案为浓硫酸;防止空气中水蒸气、CO2进入U型管被吸收;
(2)导管A处缓缓鼓入一定量的空气的目的是把反应产生的CO2全部导入U形管中,故答案为把反应产生的CO2全部导入U形管中;
(3)设NaHCO3和Na2CO3的质量分别为x、y,则x+y=17.90,![]() +
+![]() =
=![]() ,两式联立解得x=12.6g,该样品中NaHCO3的质量分数为
,两式联立解得x=12.6g,该样品中NaHCO3的质量分数为![]() ×100%=70.4%,故答案为70.4%;
×100%=70.4%,故答案为70.4%;
方案二:小烧杯中加入足量Ba(OH)2溶液,NaHCO3和Na2CO3均反应,生成沉淀为碳酸钡,判断沉淀是否完全的方法是取少量滤液,再滴加少许Ba(OH)2溶液,如无白色沉淀说明沉淀完全,故答案为取少量滤液,再滴加少许Ba(OH)2溶液,如无白色沉淀说明沉淀完全。


科目:高中化学 来源: 题型:
【题目】25℃时,下列溶液中水的电离程度最小的是
A. pH=11的氨水 B. 0.01 mol/L的Na2CO3溶液
C. 0.01 mol/L的盐酸 D. pH=4的NaHSO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明![]() 溶液中存在水解平衡SO32-+H2OHSO3-+OH-的事实是
溶液中存在水解平衡SO32-+H2OHSO3-+OH-的事实是
A.滴入酚酞溶液变红,再加入![]() 溶液红色褪去
溶液红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,在加入![]() 溶液后产生沉淀且红色褪去
溶液后产生沉淀且红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组以重铬酸钾(K2Cr2O7)溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”。
已知:①K2Cr2O7溶液存在平衡:Cr2O![]() +H2O
+H2O![]() 2CrO
2CrO![]() +2H+。
+2H+。
②含铬元素的离子在溶液中的颜色:Cr2O![]() (橙色);CrO
(橙色);CrO![]() (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。

(1)i可证明反应Cr2O![]() +H2O
+H2O![]() 2CrO
2CrO![]() +2H+的正反应是__________(填“吸热”或“放热”)。
+2H+的正反应是__________(填“吸热”或“放热”)。
(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是_________。
(3)iii的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的________(填“能”或“不能”),理由是____________。
(4)根据实验Ⅱ中不同现象,可以得出的结论是__________。
(5)继续实验

①解释溶液变黄的主要原因是________。
②溶液变绿色,该反应的离子方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俗名为“臭碱”的硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。设NA为阿伏加德罗常数的数值,下列说法正确的是( )
Na2S+2CO2↑。设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 0.1 mol·L-1的Na2SO4溶液中含SO42-的数目为0.1NA
B. 1 mol 13C原子所含中子数为6NA
C. 78 g Na2S中所含离子总数为2NA
D. 标准状况下,2.24 L CO2所含氧原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2CO3溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HCO3-)+c( CO32-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)是印染工业的一种常用原料,又称保险粉,是一种白色粉末,易溶于水,但不溶于乙醇,在碱性介质中稳定。
(1)Na2S2O4中S元素的化合价为____。
(2)连二亚硫酸钠在潮湿空气中极不稳定,易分解并引起燃烧,甚至发生爆炸,反应的化学方程式为:2Na2S2O4=Na2S2O3+Na2SO3+___。保存“保险粉”时常加入少量Na2CO3固体,目的是___。
(3)Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,当氧化剂和还原剂的物质的量之比为1:2时,反应产物的化学式为____。
(4)工业上可用如图装置电解NaHSO3和NaC1溶液制Na2S2O4。总反应为:2NaHSO3+2NaC1![]() Na2S2O4+2NaOH+C12↑
Na2S2O4+2NaOH+C12↑

①惰性电极a连接电源的____(填“正极”或“负极”),其电极反应式为____;
②若不加隔膜,则连二亚硫酸钠产率降低,其原因是____。
向银离子的乙二胺四乙酸(EDTA)配合物溶液中,滴加用NaOH碱化的连二亚硫酸钠溶液可生成纳米级银粉,该方法能用来测定Na2S2O4纯度,其反应原理可简单表示为:2Ag++S2O42-+4OH-=2Ag↓+2SO32-+2H2O。现取5.000g粗产品用上述方法测定纯度,将制得纳米级银过滤、洗涤、干燥、称量,其质量为4.320g。计算粗产品中连二亚硫酸钠的质量分数为____。测得连二亚硫酸钠的纯度比实际值小,若排除实验过程中的操作误差,分析可能的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用图示实验装置可完成多种实验,其中不能达到相应实验目的的是

选项 | 试剂1、试剂2 | 实验目的 |
A | 过量锌粒、食醋溶液 | 测定食醋中醋酸浓度 |
B | 粗锌、过量稀硫酸 | 测定粗锌(含有不参与反应的杂质)纯度 |
C | 碳酸钠固体、水 | 证明碳酸钠水解吸热 |
D | 过氧化钠固体、水 | 证明过氧化钠与水反应产生气体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及硼的化合物有着广泛的用途。请回答下列问题:
(1)硼酸(H3BO3)在水中电离出阴离子B(OH)4-,请试着写出硼酸的电离方程式___________。
(2)已知:H3BO3的电离常数Ka=5.8×1010,H2S的电离常数掏Ka1=5.7×108、Ka2=1.2×1015,向饱和硼酸溶液中滴加0.1 mol·L1 Na2S溶液,写出发生反应的离子方程式_________。
(3)BCl3主要用作半导体硅的掺杂源,遇水强烈水解,0.01mol BCl3溶于300mL蒸馏水中(溶液体积变化忽略不计),则所得溶液的pH值约为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com