
科目: 来源: 题型:
【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
(1)取冰醋酸配制250 mL 0.4 mol·L-1的醋酸溶液,用0.4 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
①将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示。则稀释过程中溶液的pH由大到小的顺序______(填字母)。

②配制250 mL 0.4 mol·L-1 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和____________。
③为标定该醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
该醋酸溶液的准确浓度为_____________(保留小数点后四位),上述标定过程中,造成测定结果偏高的原因可能是_______________(多选、错选不得分)。
a.未用标准液润洗碱式滴定管
b.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
c.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
d.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
(2)该小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度( mol·L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
①根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是______________________________________________________________。
②简述用pH试纸测 0.1mol·L-1 醋酸溶液pH的方法___________。
③利用水解理论设计实验证明醋酸的酸性比碳酸的强:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
① 写出放电时负极的电极反应式:______________________________;
② 铅蓄电池放电时,溶液的pH将_________(填增大、减小或不变)。当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为___________。
③ 放电完后,对该电池进行充电,在连接电源的负极一端生成________。(填“Pb”或“PbO2”)
(2)下图是某宇宙飞船中使用的氢氧燃料电池。其导电介质为KOH,总反应为:2H2 + O2=2H2O。
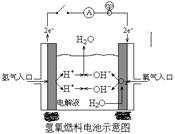
① 则负极通入的是_______,(填“H2”或“O2”)负极电极反应式为:_______________________,正极电极反应式为:______________________。
②如把导电介质改为稀H2SO4,则电极反应式为:负极__________________,正极______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】3-己烯醇乳酸酯( ![]() )常被用于具有花香的日化香精中和具有果香的食品香精中,并为整个配方带来柔和青果香的效果,下列对其说法不正确的是( )
)常被用于具有花香的日化香精中和具有果香的食品香精中,并为整个配方带来柔和青果香的效果,下列对其说法不正确的是( )
A.该物质难溶于水
B.该物质可以发生酯化反应和水解反应
C.1 mol该物质最多可与1 mol Na发生反应
D.该物质既能使酸性高锰酸钾溶液褪色,也能使溴的四氯化碳溶液褪色 ,且褪色原理相同
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组查阅资料:“氯气与硫在加热条件下生成二氯化硫(S2Cl2),该物质遇水迅速反应,他们利用如下仪器和药品制取纯净的氯气与硫反应来制备S2Cl2
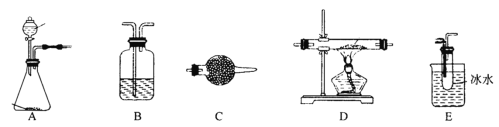
实验过程所提供的药品有:浓盐酸、浓H2SO4、MnO2、KMnO4(H+)、饱和NaHCO3溶液、碱石灰、硫磺、NaOH溶液、冰水、饱和食盐水。
回答下列问题:
(1)利用所提供的设备和药品,写出制备Cl2的离子方程式:________________
(2)在该实验过程中两次用到仪器B,第一次装置B中的药品是____________,第二次装置B的作用是____________________________________________________。
(3)能否省略装置C________(填“能”或“否”),原因是_________________________________。
(4)实验开始后,当_______________________________________________,(填现象)点燃D处的酒精灯。
(5)某学生利用装置A制备一定量的Cl2,他收集到的Cl2的体积总比预期的要多,他经过认真分析后,认为应对装置A略作改进,你认为怎样改进:_____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】NaClO2(亚氯酸纳)是常用的消毒剂和漂白剂,工业上可采用电解法制备,工作原理如图所示。下列叙述正确的是
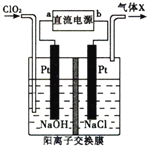
A. 若直流电源为铅蓄电池,则b极为Pb
B. 阳极反应式为ClO2+e-=ClO2-
C. 交换膜左测NaOH的物质的量不变,气体X为Cl2
D. 制备18.1gNaClO2时理论上有0.2molNa+由交换膜左侧向右侧迁移
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图像如图所示,下列说法正确的是
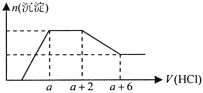
A.原溶液中一定含有的阴离子是OH-、SiO32-、AlO2-、CO32-
B.反应最后形成的溶液中的溶质为NaCl
C.原溶液中一定含有Na2SO4
D.原溶液中含有CO32-与AlO2-的物质的量之比为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体![]() ,放电时有关离子转化如图所示.下列说法正确的是
,放电时有关离子转化如图所示.下列说法正确的是
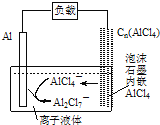
A.放电时,负极发生:![]()
B.放电时,电路中每流过3mol电子,正极减少27g
C.充电时,泡沫石墨极与外电源的负极相连
D.充电时,阴极发生:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】高炉煤气为炼铁过程中产生的副产品,主要成分为N2、CO、CO2、H2O等,其中可燃成分CO含量约占25%左右,CO2、N2的含量分别占15%、55%。回答下列问题:
(1)上述提及的气体分子中,电子数相等的两种气体是_____________(写化学式)。
(2)CO可以用于生产甲醇,甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H=-90.8kJ/mol
己知:2H2(g)+O2(g)═2H2O(l) △H=-571.6kJ·mol-1
2H2(g)+O2(g)═2H2O(g) △H=-483.6kJ`mol-1
①H2的燃烧热为___________________ kJ/mol。
②CH3OH(g)+O2(g)![]() CO(g) +2H2O(g)的反应热△H=___________________。
CO(g) +2H2O(g)的反应热△H=___________________。
③若在恒温恒容的容器内进行反应CO(g)+2H2(g)![]() CH3OH(g),则可用来判断该反应达到平衡状态的标志有______________________。(填字母)
CH3OH(g),则可用来判断该反应达到平衡状态的标志有______________________。(填字母)
A.CO百分含量保持不变 B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变 D.CO的生成速率与CH3OH的生成速率相等
(3)高炉煤气中N2的含量较高,利用CO前需要对CO 进行富集,实现CO和N2的分离。工业上常采用醋酸亚铜氨溶液来吸收CO,该反应的热化学方程式为 CH3COOCu(NH3)2(aq)+CO(g)![]() CH3COOCu(NH3)2·CO(aq) △H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有______________(写出一种即可)。
CH3COOCu(NH3)2·CO(aq) △H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有______________(写出一种即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】生活中常用的净水剂KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐( 主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
![]()
(1)为尽量少引入杂质,试剂①应选用__________ (填标号)。
A.HCl溶液 B.H2SO4 溶液 C.氨水 D.NaOH溶液
(2)沉淀B的化学式为______________;将少量明矾溶于水,溶液呈弱酸性,其原因是_________________________________ (用离子方程式表示)。
(3)科学研究证明NaAlO2 在水溶液中实际上是Na[Al(OH)4](四羟基合铝酸钠),易拉罐溶解过程中主要反应的化学方程式为_______________________________________。
(4)常温下,等pH的NaAlO2 和NaOH两份溶液中,由水电离出的c(OH-)前者为后者
的108倍,则两种溶液的pH=__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是
A. 常温下,pH均为9的CH3COONa和NaOH溶液中,水的电离程度不相同
B. 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH>0
C. 向浓度均为0.1 molL-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,说明Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
D. 向盛有KI3溶液(I3-![]() I2+I-)的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-)的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com