
【题目】3-己烯醇乳酸酯( ![]() )常被用于具有花香的日化香精中和具有果香的食品香精中,并为整个配方带来柔和青果香的效果,下列对其说法不正确的是( )
)常被用于具有花香的日化香精中和具有果香的食品香精中,并为整个配方带来柔和青果香的效果,下列对其说法不正确的是( )
A.该物质难溶于水
B.该物质可以发生酯化反应和水解反应
C.1 mol该物质最多可与1 mol Na发生反应
D.该物质既能使酸性高锰酸钾溶液褪色,也能使溴的四氯化碳溶液褪色 ,且褪色原理相同
科目:高中化学 来源: 题型:
【题目】醋酸是一种常见的弱酸,请回答:
(1)已知某温度时,醋酸的电离平衡常数Ka=1.6×10-5。
①醋酸的起始浓度为0.010mol/L,平衡时c(H+)=______(提示:醋酸的电离平衡常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.010mol/L
②pH=1的醋酸与pH=l的盐酸等体积混合,混合后溶液中c(CH3COO-)=_______。
(2)日常生活中常用醋酸除水垢,但工业锅炉的水垢中常含有CaSO4,需先用________(填化学式)溶液处理,而后用盐酸去除。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.向NaHCO3溶液中加入足量的Ba(OH)2:2HCO3-+Ba2++2OH-=BaCO3↓+ CO32-+2H2O
B.向亚硫酸钠溶液中滴入少量新制的氯水:3SO32-+ Cl2+H2O= SO42-+2Cl-+2HSO3-
C.电解KI溶液阴极电极反应2H2O-4e-= O2↑+4H+
D.Fe2O3固体投入到少量HI溶液中:Fe2O3+6H++6I-=2Fe2++3I2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解苦卤水![]() 含
含![]() 、
、![]() 、
、![]() 、
、![]() 的装置如图所示
的装置如图所示![]() 、b为石墨电极
、b为石墨电极![]() ,下列说法正确的是
,下列说法正确的是
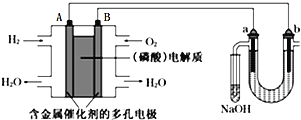
A.电池工作时,B极反应式为![]()
B.电解时,电子流动路径是:A极![]() 外电路
外电路![]() 极
极![]() 溶液
溶液![]() 极
极![]() 极
极
C.NaOH溶液充分吸收后所得溶液可制作漂白水
D.当电池中消耗![]() 标准状况
标准状况![]() 时,a极周围也会产生
时,a极周围也会产生![]() 标准状况
标准状况![]() 气体
气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉煤气为炼铁过程中产生的副产品,主要成分为N2、CO、CO2、H2O等,其中可燃成分CO含量约占25%左右,CO2、N2的含量分别占15%、55%。回答下列问题:
(1)上述提及的气体分子中,电子数相等的两种气体是_____________(写化学式)。
(2)CO可以用于生产甲醇,甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H=-90.8kJ/mol
己知:2H2(g)+O2(g)═2H2O(l) △H=-571.6kJ·mol-1
2H2(g)+O2(g)═2H2O(g) △H=-483.6kJ`mol-1
①H2的燃烧热为___________________ kJ/mol。
②CH3OH(g)+O2(g)![]() CO(g) +2H2O(g)的反应热△H=___________________。
CO(g) +2H2O(g)的反应热△H=___________________。
③若在恒温恒容的容器内进行反应CO(g)+2H2(g)![]() CH3OH(g),则可用来判断该反应达到平衡状态的标志有______________________。(填字母)
CH3OH(g),则可用来判断该反应达到平衡状态的标志有______________________。(填字母)
A.CO百分含量保持不变 B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变 D.CO的生成速率与CH3OH的生成速率相等
(3)高炉煤气中N2的含量较高,利用CO前需要对CO 进行富集,实现CO和N2的分离。工业上常采用醋酸亚铜氨溶液来吸收CO,该反应的热化学方程式为 CH3COOCu(NH3)2(aq)+CO(g)![]() CH3COOCu(NH3)2·CO(aq) △H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有______________(写出一种即可)。
CH3COOCu(NH3)2·CO(aq) △H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有______________(写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬酸钾![]() 为原料,用电化学法制备重铬酸钾
为原料,用电化学法制备重铬酸钾![]() 的实验装置如图,其反应原理可表示为4K2CrO4+4H2O
的实验装置如图,其反应原理可表示为4K2CrO4+4H2O![]() 2K2Cr2O7+4KOH+2H2↑+O2↑,下列说法中正确的是( )
2K2Cr2O7+4KOH+2H2↑+O2↑,下列说法中正确的是( )
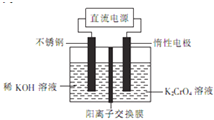
A.在阴极室,随着反应的进行溶液的pH逐渐变小
B.不锈钢电极上生成![]() ,惰性电极上得到
,惰性电极上得到![]()
C.惰性电极发生的电极反应为![]()
D.不锈钢应连接直流电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 代表阿伏加德罗常数的值,下列有关说法正确的是
代表阿伏加德罗常数的值,下列有关说法正确的是![]()
![]()
A.![]() 冰醋酸晶体中,含阴离子数目为
冰醋酸晶体中,含阴离子数目为![]()
B.标准状况下,![]() 中含有分子的数目为
中含有分子的数目为![]()
C.常温下,![]() 与
与![]() 混合气体中含分子数为
混合气体中含分子数为![]()
D.![]() 投入
投入![]() 的浓硝酸中,充分反应后转移电子数为
的浓硝酸中,充分反应后转移电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A.常温下,10 mL pH=1的醋酸溶液中含有的氢离子数为0.001NA
B.合成氨反应中,1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.用碱性锌锰干电池作电源电解饱和食盐水,当消耗MnO2 8.7g时,可制得标况下氯气2.24L(不考虑氯气的溶解;电池工作时MnO2转化为MnOOH)
D.常温常压下,18.4 g NO2和N2O4的混合气体中含有的氮原子总数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/LNaOH和0.1mol/LNH4Cl溶液等体积混合后,离子浓度大小正确的次序是( )
A.c(Na+)>c(Cl-)>c(OH-)>c(H+)
B.c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.c(Na+)=c(Cl-)>c(H+)>c(OH-)
D.c(Cl-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com