
科目: 来源: 题型:
【题目】![]() 是阿伏加德罗常数的值。下列说法正确的是
是阿伏加德罗常数的值。下列说法正确的是
A.![]() 乙烯和丙烯的混合气体中含有的碳碳双键数为
乙烯和丙烯的混合气体中含有的碳碳双键数为![]()
B.标准状况下,![]() 中含有的中子数
中含有的中子数![]()
C.含![]() 的浓硫酸与足量Cu反应,转移电子数为
的浓硫酸与足量Cu反应,转移电子数为![]()
D.![]() 乙酸与足量乙醇反应的生成物中含酯基官能团数为
乙酸与足量乙醇反应的生成物中含酯基官能团数为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应2A(g)+2B(g)![]() C(g)+2D(g),在容器均为2L的甲,乙,丙三个恒温(反应温度分别为300℃,T℃,300℃)容器中分别加入物质的量之比为1:1的A和B,测得各容器中n(B)随反应时间t的变化情况如下表所示:
C(g)+2D(g),在容器均为2L的甲,乙,丙三个恒温(反应温度分别为300℃,T℃,300℃)容器中分别加入物质的量之比为1:1的A和B,测得各容器中n(B)随反应时间t的变化情况如下表所示:
0 | 40 | 80 | 120 | 160 | |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
丙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
根据表中数据,下列说法正确的是
A.乙容器中的反应温度T<300
B.丙容器中,0-40min内用A的浓度变化表示的平均反应速率为为0.05mol/(L·min)
C.若起始时向甲容器中加入0.2、0.2、0.4和1.2,则反应将向正反应方向进行
D.在0-40min内,提高乙容器中的A的转化率的有效途径是使用高效催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
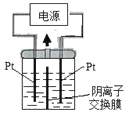
已知:3I2+6OH—=IO3—+5I—+3H2O
下列说法不正确的是
A. 右侧发生的电极方程式:2H2O+2e—=H2↑+2OH—
B. 电解结束时,右侧溶液中含有IO3—
C. 电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸在水溶液中存在下列电离平衡:CH3COOH![]() CH3COO+H+,下列说法不正确的是
CH3COO+H+,下列说法不正确的是
A.加入醋酸钠晶体后,溶液的pH增大
B.加入碳酸钠,平衡向右移动
C.加水稀释,溶液中c(H+)和c(OH-)均减少
D.升高温度,Ka(CH3COOH)增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是
A.将纯水加热的过程中,Kw变大、pH变小
B.配制FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1mol/L氨水中加入少量水,溶液中![]() 减小
减小
查看答案和解析>>
科目: 来源: 题型:
【题目】从镍矿石尾矿中提取NiSO4是解决我国镍资源匮乏的一条重要途径,已知该过程如下:
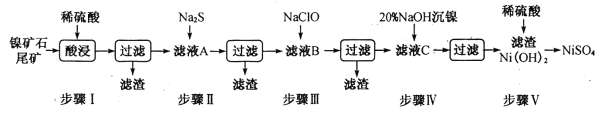
表1:各物质的Ksp数据如下表:
物质 | MnS | NiS | PbS | CuS | Ni(OH)2 |
Ksp | 2.5×10-13 | 1.1×10-21 | 8.0×10-28 | 6.3×10-36 | 2.0×10-15 |
表2:滤液A中各金属离子的含量如下表:
成分 | Ni2+ | Fe3+ | Fe2+ | Mn2+ | Cu2+ | Pb2+ | …… |
含量/g·L-1 | 3.80 | 4.80 | x | 0. 20 | 0.15 | <0.001 | …… |
根据以上信息,回答下列问题:
(1)步骤I酸浸之前需将矿石粉碎,目的是_______________。
(2)
(3)常温下进行步骤Ⅲ的目的是为了除去铁和锰元素,已知除铁元素的离子反应如下:2Fe2++ ClO - +5H2O=2Fe( OH)3↓+Cl- +4H+,此时Mn2+的氧化产物为MnO2,写出除锰元素的离子方程式_____________。
(4)所得Ni(OH)2是制造镍镉电池的重要原料,镍镉电池工作原理如下:Cd+2NiO(OH) +2H2O![]() Cd(OH)2+2Ni(OH)2,则随着放电的进行,正极区pH______(填“增大”、“减小”或“不变”);充电时阴极电极反应式为______________________。
Cd(OH)2+2Ni(OH)2,则随着放电的进行,正极区pH______(填“增大”、“减小”或“不变”);充电时阴极电极反应式为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是
A.![]() 和CO的混合物中,所含分子总数为
和CO的混合物中,所含分子总数为![]()
B.精炼铜时,阳极质量减少64g时转移电子数![]()
C.![]() 时,
时,![]() 的纯水中,含
的纯水中,含![]() 数为
数为![]()
D.![]() 溶液中含
溶液中含![]() 数为
数为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是![]()
![]()
A.![]() 葡萄糖和
葡萄糖和![]() 果糖的混合物中羟基数目为
果糖的混合物中羟基数目为![]()
B.标准状况下,![]() 一氟甲烷中H原子数目为
一氟甲烷中H原子数目为![]()
C.![]() 溶液中离子总数大于
溶液中离子总数大于![]()
D.![]() 在稀硫酸作用下水解生成乙醇分子数目为
在稀硫酸作用下水解生成乙醇分子数目为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】请根据所学知识回答下列问题:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1_______△H2(填“>”、“<”或“=”,下同)。
(2)已知常温时红磷比白磷稳定,比较下列反应中△H的大小:△H1_______△H2。
①P4(白磷,s)+5O2(g)=2P2O5(s) △H1
②4P(红磷,s)+5O2(g)=2P2O5(s) △H2
(3)已知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量__________57.3kJ。
(4)已知:0.5 mol CH4(g)与0.5 mol水蒸气在t℃、pkPa时,完全反应生成CO和H2的混合气体,吸收了a kJ热量,该反应的热化学方程式是___________________________________。
(5)氨气是一种重要的物质,可用于制取化肥和硝酸等。已知H-H键、N-H键、N≡N键的键能分别是436 kJ·mol-1、391 kJ·mol-1、946 kJ·mol-1。写出合成氨的热反应方程式:___________________________________。生成1 mol NH3需要吸收或放出________kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com