
【题目】醋酸在水溶液中存在下列电离平衡:CH3COOH![]() CH3COO+H+,下列说法不正确的是
CH3COO+H+,下列说法不正确的是
A.加入醋酸钠晶体后,溶液的pH增大
B.加入碳酸钠,平衡向右移动
C.加水稀释,溶液中c(H+)和c(OH-)均减少
D.升高温度,Ka(CH3COOH)增大
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是

A.该装置工作时,H+由b极区流向a极区
B.该制氢工艺中光能最终转化为化学能
C.a极上发生的电极反应为Fe3++e-=Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知400℃和1.01×105Pa时的气体摩尔体积为55.20 L/mol,在该条件下有1 mol气体X发生如下反应并达到平衡:2X(g)=mY(g)+Z(g),测得平衡混合气中X的体积分数为58.80%,混合气体的总质量为46.00 g,混合气体的密度为0.72 g/L。则平衡混合气体的平均相对分子质量为 ( )
A.58.80B.6.00C.39.74D.16.13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的NO(g)是导致光化学烟雾和破坏臭氧层的重要源头之一。现拟用下列方法处理NO,根据题意回答下列问题:
(1)采用某种催化剂催化分解NO,发生反应2NO(g)![]() N2(g)+O2(g),在T1℃和T2℃时(T1>T2)NO的转化率随时间变化的结果如图所示。
N2(g)+O2(g),在T1℃和T2℃时(T1>T2)NO的转化率随时间变化的结果如图所示。
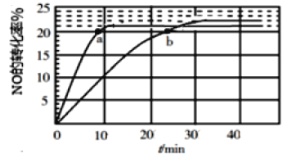
①反应2NO(g)![]() N2(g)+O2(g)为____________(填“吸热”或“放热”)反应。
N2(g)+O2(g)为____________(填“吸热”或“放热”)反应。
②T2℃时,反应的平衡常数K=__________(保留2位小数)。
③在T1℃下,要提高NO转化率,可采取的措施是_________________________
④比较a、b处反应速率大小:υa(正)________υb(逆)(填“大于”“小于”或“等于”)。已知反应速率υ正=k正x2(NO),υ逆=k逆x(N2)·x(O2),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算b点处![]() =__________(保留1位小数)。
=__________(保留1位小数)。
(2)臭氧也可用于处理NO,O3氧化NO结合水洗可产生HNO3和O2,若生成1 mol的HNO3则转移_______ mol电子。
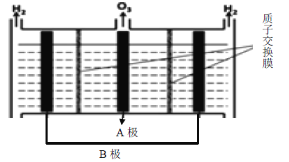
(3)O3可由电解稀硫酸制得,原理如下图所示,图中阴极为________(填“A”或“B”),阳极(惰性电极)的电极反应式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据所学知识回答下列问题:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1_______△H2(填“>”、“<”或“=”,下同)。
(2)已知常温时红磷比白磷稳定,比较下列反应中△H的大小:△H1_______△H2。
①P4(白磷,s)+5O2(g)=2P2O5(s) △H1
②4P(红磷,s)+5O2(g)=2P2O5(s) △H2
(3)已知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量__________57.3kJ。
(4)已知:0.5 mol CH4(g)与0.5 mol水蒸气在t℃、pkPa时,完全反应生成CO和H2的混合气体,吸收了a kJ热量,该反应的热化学方程式是___________________________________。
(5)氨气是一种重要的物质,可用于制取化肥和硝酸等。已知H-H键、N-H键、N≡N键的键能分别是436 kJ·mol-1、391 kJ·mol-1、946 kJ·mol-1。写出合成氨的热反应方程式:___________________________________。生成1 mol NH3需要吸收或放出________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数值。下列有关叙述正确的是
为阿伏加德罗常数值。下列有关叙述正确的是![]()
![]()
A.电解精炼粗铜![]() 含有锌铁等杂质
含有锌铁等杂质![]() ,若阳极溶解32g铜,转移电子数目为
,若阳极溶解32g铜,转移电子数目为![]()
B.![]() 分子结构如图
分子结构如图![]() 含
含![]() 键数为
键数为![]()

C.某温度下,![]() 的
的![]() 溶液中含有的
溶液中含有的![]() 数目为
数目为![]()
D.氢氧燃料电池正极消耗![]() 气体时,负极消耗的气体分子数目为
气体时,负极消耗的气体分子数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)电解质由强至弱顺序为_________________(用化学式表示,下同)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为 ,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者 后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____________。
(4)NaHSO3溶液显酸性的原因___________________________(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄是一种常见水果,可以生食或制作葡萄干,除此之外,葡萄还可用于酿酒。
(1)检验葡萄汁含有葡萄糖的方法是:向其中加碱调至碱性,再加入新制的Cu(OH)2并加热,其现象是________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式:C6H12O6(葡萄糖)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)葡萄酒密封储存过程中会生成有香味的酯类,酯类也可以通过化学实验来制备,实验室可用如图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是__________。
②试管b中盛放的试剂是饱和____________溶液。
③实验开始时,试管b中的导管不伸入液面下的原因是________。
④若要分离出试管b中的乙酸乙酯,需要用到的仪器是_______(填字母)。
A.普通漏斗 B.分液漏斗 C.长颈漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于氧化还原反应的是
A.2H2O2 ![]() 2H2O + O2↑B.NH4Cl
2H2O + O2↑B.NH4Cl![]() NH3↑ + HCl↑
NH3↑ + HCl↑
C.2Al + Fe2O3![]() 2Fe + Al2O3D.Cu + 2H2SO4(浓)
2Fe + Al2O3D.Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑ + 2H2O
CuSO4 + SO2↑ + 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com