
����Ŀ������β���е�NO(g)�ǵ��¹⻯ѧ�������ƻ����������ҪԴͷ֮һ�����������з�������NO����������ش��������⣺
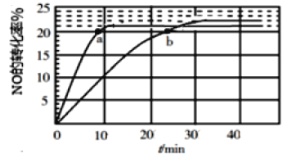
(1)����ij�ִ������ֽ�NO��������Ӧ2NO(g)![]() N2(g)��O2(g)����T1���T2��ʱ(T1>T2)NO��ת������ʱ��仯�Ľ����ͼ��ʾ��
N2(g)��O2(g)����T1���T2��ʱ(T1>T2)NO��ת������ʱ��仯�Ľ����ͼ��ʾ��
�ٷ�Ӧ2NO(g)![]() N2(g)��O2(g)Ϊ____________(��������������������)��Ӧ��
N2(g)��O2(g)Ϊ____________(��������������������)��Ӧ��
��T2��ʱ����Ӧ��ƽ�ⳣ��K��__________(����2λС��)��
����T1���£�Ҫ���NOת���ʣ��ɲ�ȡ�Ĵ�ʩ��_________________________
�ܱȽ�a��b����Ӧ���ʴ�С����a(��)________��b(��)(������������С��������������)����֪��Ӧ����������k��x2(NO)��������k��x(N2)��x(O2)��k����k���ֱ�Ϊ��������Ӧ���ʳ�����xΪ���ʵ�������������b�㴦![]() ��__________(����1λС��)��
��__________(����1λС��)��
(2)����Ҳ�����ڴ���NO��O3����NO���ˮϴ�ɲ���HNO3��O2��������1 mol��HNO3��ת��_______ mol���ӡ�
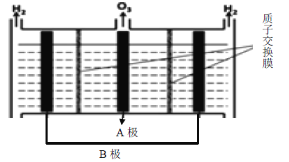
(3)O3���ɵ��ϡ�����Ƶã�ԭ������ͼ��ʾ��ͼ������Ϊ________(����A������B��)������(���Ե缫)�ĵ缫��ӦʽΪ___________________________________��
���𰸡����� 0.02 �跨ȡ��һ���������� ���� 1.3 3 B 3H2O-6e-=O3��+6H+
��������
(1)��ͼ�п��Կ������������ߴ�ƽ���ʱ�䲻ͬ����ΪT1>T2�������ȴ�ƽ�������ΪT1��ʱ�����ߡ�
�ٴ�NO��ת���ʿ��Կ������¶ȵ�ʱת���ʴ�����ƽ�������ƶ����ɴ˵ó�2NO(g)![]() N2(g)��O2(g)�ķ�Ӧ��ЧӦ��
N2(g)��O2(g)�ķ�Ӧ��ЧӦ��
��T2��ʱ��NO��ת����Ϊ22%����������ʽ����ƽ������ϵ���������Ӧ��ƽ�ⳣ��K��
����T1���£�Ҫ���NOת���ʣ��ɴӸı��¶ȼ��������Ũ��Ѱ�Ҵ�ʩ��
�ܱȽ�va(��)��vb(��)ʱ���ɴ��¶ȷ������ȴ�ƽ��㣬����v��=v�����![]() ��Ȼ���������ʹ�ʽ������b�㴦
��Ȼ���������ʹ�ʽ������b�㴦![]() ��
��
(2)����Ҳ�����ڴ���NO��O3����NO���ˮϴ�ɲ���HNO3��O2��������1 mol��HNO3���������NԪ�صļ�̬�仯��ȷ��ת�Ƶ��ӵ����ʵ�����
(3)O3���ɵ��ϡ�����Ƶã���������H2���ɴ�ȷ��ͼ����������������ˮʧ��������O3�ķ�Ӧ��
(1)��ͼ�п��Կ������������ߴ�ƽ���ʱ�䲻ͬ����ΪT1>T2�������ȴ�ƽ�������ΪT1��ʱ�����ߡ�
�ٴ�NO��ת���ʿ��Կ������¶ȵ�ʱת���ʴ�����ƽ�������ƶ����ɴ˵ó�2NO(g)![]() N2(g)��O2(g)Ϊ���ȷ�Ӧ����Ϊ�����ȣ�
N2(g)��O2(g)Ϊ���ȷ�Ӧ����Ϊ�����ȣ�
��T2��ʱ�����ڸ÷�Ӧ��Ӧǰ��ѧ��������ȣ���NO����ʼ���ʵ���Ϊ2mol���������ݻ�Ϊ1L��
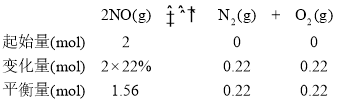
��Ӧ��ƽ�ⳣ��K=![]() =0.02����Ϊ��0.02��
=0.02������0.02��
����T1���£���Ϊ�Ӵ������ı�ѹǿ��������ʹƽ�ⷢ���ƶ�������Ҫ���NOת���ʣ�ֻ�ܴ��������Ũ��Ѱ�Ҵ�ʩ���ʿɲ�ȡ�Ĵ�ʩ���跨ȡ��һ�����������Ϊ���跨ȡ��һ���������
����Ϊa����¶ȸ���b�㣬����va(��)> vb(��)��T2��ƽ��ʱv��=v����x��NO��=0.78��x��N2��=x��O2��=0.11����k����0.782=k����0.11��0.11����![]() =0.02����b��ʱ������ʽ��ϵ���£�
=0.02����b��ʱ������ʽ��ϵ���£�
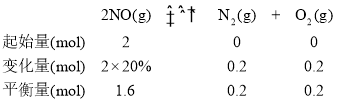
��ʱx��NO��=0.8��x��N2��=x��O2��=0.1��b��ʱ��![]() =
=![]() =0.02��82=1.3������>��1.3��
=0.02��82=1.3������>��1.3��
(2)O3����NO���ˮϴ�ɲ���HNO3��O2����Ӧ����ʽΪ3O3+2NO+H2O=2HNO3+3O2��������1 mol��HNO3����NԪ����+2�����ߵ�+5�ۣ�ת�Ƶ��ӵ����ʵ���Ϊ3mol����Ϊ��3��
(3)O3���ɵ��ϡ�����Ƶã���������H2���ɴ�ȷ��ͼ������ΪB��AΪ����������������ӦΪ3H2O-6e-=O3��+6H+����Ϊ��B��3H2O-6e-=O3��+6H��


 ����������ϵ�д�
����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����ģ�ҵƯ��Һ����Ч�ɷ�ΪNaClO���ѳ���ˮ�а�����NH3�����������£�
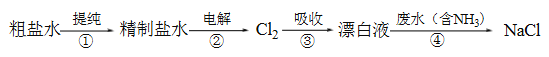
���з�����ȷ����
A. ���в�������ķ������ƴ���ˮ
B. ������������Ҫ�缫��Ӧ��4OH- - 4e- = 2H2O + O2��
C. �����Ʊ�Ư��Һ�ķ�Ӧ��Cl2 + OH- = Cl- + HClO
D. �ڡ��ۡ����о�������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ����٤��������ֵ������˵���������
A. �����ʵ�����Na2O��Na2O2�к��е�����������ΪNA
B. ���³�ѹ��14gCO��N2�Ļ�������к��е�ԭ����ΪNA
C. 1L1mol/L����������Һ����������С��2NA
D. 18g������NaOH��Һ������ת�Ƶ�������Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵĵ���ƽ�⡢�����ˮ��ƽ�����������ܽ�ƽ������ڻ�ѧƽ�⡣
(1)��25��ʱ����c mol��L��1�Ĵ�����Һ��0.02 mol��L��1 NaOH��Һ�������Ϻ���Һ�պó����ԣ��ú�c�Ĵ���ʽ��ʾCH3COOH�ĵ��볣��Ka��________��
(2)25��ʱ��H2SO3![]() HSO3����H���ĵ��볣��Ka��1��10��2 mol��L��1������¶���NaHSO3ˮ�ⷴӦ��ƽ�ⳣ��Kb��________mol��L��1������NaHSO3��Һ�м���������I2������Һ��
HSO3����H���ĵ��볣��Ka��1��10��2 mol��L��1������¶���NaHSO3ˮ�ⷴӦ��ƽ�ⳣ��Kb��________mol��L��1������NaHSO3��Һ�м���������I2������Һ�� ��________(����������������С������������)��
��________(����������������������������)��
(3)��֪H2A��ˮ�д�������ƽ�⣺H2A��H����HA����HA��![]() H����A2����������H2A�ĸ���(CaA)�ı�����Һ�д�������ƽ�⣺CaA(s)
H����A2����������H2A�ĸ���(CaA)�ı�����Һ�д�������ƽ�⣺CaA(s)![]() Ca2��(aq)��A2��(aq) ��H>0����Ҫʹ����Һ��Ca2��Ũ�ȱ�С���ɲ�ȡ�Ĵ�ʩ��________��
Ca2��(aq)��A2��(aq) ��H>0����Ҫʹ����Һ��Ca2��Ũ�ȱ�С���ɲ�ȡ�Ĵ�ʩ��________��
A.�����¶� B.�����¶� C.����NH4Cl���� D.����Na2A����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() Ϊ�����ӵ�������ֵ������˵����ȷ����
Ϊ�����ӵ�������ֵ������˵����ȷ����![]()
![]()
A.![]() ��������������Ϊ
��������������Ϊ![]()
B.36g����������ǵĻ�����к����ǻ�����ĿΪ![]()
C.�ö��Ե缫���ϡ����Ĺ����У���Һ������ÿ����![]() ת�Ƶ�����Ϊ
ת�Ƶ�����Ϊ![]()
D.![]() ��
��![]() ֮��Ϊ1mol��
֮��Ϊ1mol��![]() ��Һ�У����е�
��Һ�У����е�![]() ��ĿΪ
��ĿΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() Ϊ�����ӵ�����������������ȷ����
Ϊ�����ӵ�����������������ȷ����![]()
![]()
A.����������ˮ��Ӧʱ������![]() ת�Ƶĵ�����Ϊ
ת�Ƶĵ�����Ϊ![]()
B.![]() ��NaOH��Һ������գ�ת�Ƶĵ�����ĿΪ
��NaOH��Һ������գ�ת�Ƶĵ�����ĿΪ![]()
C.���³�ѹ�£�![]() ��
��![]() ��ϣ��������������ĿΪ
��ϣ��������������ĿΪ![]()
D.���³�ѹ�£�![]() ����������м��Ӧת�Ƶ�����ĿΪ
����������м��Ӧת�Ƶ�����ĿΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ��Һ�д������е���ƽ�⣺CH3COOH![]() CH3COO+H+������˵������ȷ����
CH3COO+H+������˵������ȷ����
A.��������ƾ������Һ��pH����
B.����̼���ƣ�ƽ�������ƶ�
C.��ˮϡ�ͣ���Һ��c(H+)��c(OH��)������
D.�����¶ȣ�Ka(CH3COOH)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ�����ʵ���Ũ�Ⱦ�Ϊ0.1molL��1�ļ�������Һ��pH�����
��� | �� | �� | �� | �� | �� |
��Һ | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)�����ӷ���ʽ������Һ����ȥ�����۵�ԭ��_____��
(2)д����Һ����ͨ����CO2�����ӷ���ʽ��_____��
(3)25��ʱ����Һ���У���ˮ���������c(H+)=_____molL��1��
(4)��0.100molL-1NH4HCO3��Һ�����ʵ���Ũ������������__________(�ѧʽ)����CH3COOH��NaOH��Ӧ�����Һ�д��ڣ�c(Na+)��c(CH3COO-)������Һ��_________��(����������������������)������Һ��������______��(�ѧʽ)
(5)����˵����ȷ����_____��
a.c(NH4+)���٣���
b.���ʵ���Ũ�Ⱥ��������ȵ�NaCl��NaX������Һ�У������������
c.������Ģۺ͢��γɵĻ����Һ�У�c(HCO3��)+c(CO32��)=0.1molL��1
d.��pH��ͬ��CH3COOH��HX��Һ��ˮϡ����ͬ������HX��Һ��pH�仯С
(6)ijͬѧ����0.1molL��1 CaCl2��Һ��������Һ�ۺ͢ݣ�������CaCl2��Һ����װ����Һ�۵��Թ���ʱ�����������벻���������Թ��г����˰�ɫ�������������������ɡ��Խ��Ͳ������������ԭ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ����Ԫ����Br����ʽ���ڣ���ҵ���ÿ����������Ӻ�ˮ����ȡ��Ĺ�����������ͼ��

��ش��������⣮
��1������ˮŨ���ķ�����__��
��2������ٷ�Ӧ�����ӷ���ʽ��__��1molCl2�μӷ�Ӧ��ת�Ƶ���__mol��
��3�������ͨ���ȿ�������Br2��������Br2��__������ţ���
A�������� B����ԭ�� C���ӷ��� D����ʴ��
��4�����������SO2��ˮ��Һ����Br2�������ʿɴ�95%���÷�Ӧ����������__���ڹ�ҵ�����д˲���Ӧ�����������__��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com