
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是![]()
![]()
A.![]() 中所含的中子数为
中所含的中子数为![]()
B.36g葡萄糖与果糖的混合物中含有羟基的数目为![]()
C.用惰性电极电解稀硫酸的过程中,溶液的质量每减少![]() 转移电子数为
转移电子数为![]()
D.![]() 和
和![]() 之和为1mol的
之和为1mol的![]() 溶液中.含有的
溶液中.含有的![]() 数目为
数目为![]()
【答案】B
【解析】
A.![]() 的物质的量为n=
的物质的量为n=![]() =0.2mol,所含中子的数目为
=0.2mol,所含中子的数目为![]() ,故A错误;
,故A错误;
B.葡萄糖和果糖的化学式均为![]() ,故36g混合物的物质的量为
,故36g混合物的物质的量为![]() =0.2mol,1个葡萄糖分子和1个果糖分子中均含5个
=0.2mol,1个葡萄糖分子和1个果糖分子中均含5个![]() ,故
,故![]() 混合物中含有的
混合物中含有的![]() 的个数为
的个数为![]() 个,故
个,故![]() 混合物中含有的
混合物中含有的![]() 的个数为
的个数为![]() 个,故B正确;
个,故B正确;
C.用惰性电极电解稀硫酸,实际电解的物质是水,电解方程式为2H2O![]() 2H2↑+O2↑,每减少2mol水时转移4mol电子,减少
2H2↑+O2↑,每减少2mol水时转移4mol电子,减少![]() 水的物质的量
水的物质的量![]() (H2O)=
(H2O)=![]() =
=![]() =0.2mol,则减少0.2mol水时转移0.4mol电子,电子转移数目为
=0.2mol,则减少0.2mol水时转移0.4mol电子,电子转移数目为![]() ,故C错误;
,故C错误;
D.![]() 溶液中物料守恒关系式为
溶液中物料守恒关系式为![]() ,所以
,所以![]() 和
和![]() 之和为1mol的
之和为1mol的![]() 溶液中,含有的
溶液中,含有的![]() 数目为大于
数目为大于![]() ,故D错误;
,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
① 写出放电时负极的电极反应式:______________________________;
② 铅蓄电池放电时,溶液的pH将_________(填增大、减小或不变)。当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为___________。
③ 放电完后,对该电池进行充电,在连接电源的负极一端生成________。(填“Pb”或“PbO2”)
(2)下图是某宇宙飞船中使用的氢氧燃料电池。其导电介质为KOH,总反应为:2H2 + O2=2H2O。
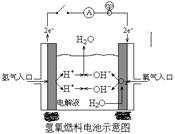
① 则负极通入的是_______,(填“H2”或“O2”)负极电极反应式为:_______________________,正极电极反应式为:______________________。
②如把导电介质改为稀H2SO4,则电极反应式为:负极__________________,正极______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G 的浓溶液中发生钝化, F 的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同)

回答下列问题:
(1)第一种情况:用两根玻璃棒分别蘸取 A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质; D 和 F 的溶液均呈碱性。则:①反应Ⅲ的化学方程式为__________________________。
②D与乙反应的离子方程式为_________________________________________
(2)第二种情况: 甲由两种单质直接化合得到;B 为红棕色固体; C为无色气体,是形成酸雨的大气污染物之一;D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则:
①工业上,反应 I的化学方程式为______________________________________生产设备名称为:__________
②D和乙反应的离子方程式为______________________________________________
③ 请简述检验D溶液中阳离子的方法__________________________________。
④ 若A的相对分子质量为120,反应Ⅰ、Ⅱ、Ⅲ均为完全转化。现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρg/cm3,溶质质量分数为a% 的G溶液n mL。则该样品中A的质量分数=_____________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知400℃和1.01×105Pa时的气体摩尔体积为55.20 L/mol,在该条件下有1 mol气体X发生如下反应并达到平衡:2X(g)=mY(g)+Z(g),测得平衡混合气中X的体积分数为58.80%,混合气体的总质量为46.00 g,混合气体的密度为0.72 g/L。则平衡混合气体的平均相对分子质量为 ( )
A.58.80B.6.00C.39.74D.16.13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月在法国凡尔赛召开了国际计量大会,会议将阿伏加德罗常数的定义修改为“1摩尔包含6.02214076×1023个基本单元,这一常数被称为阿伏加德罗常数,单位为mol-1”。若NA表示阿伏加德罗常数的值,则下列说法错误的是
A. 新定义中阿伏加德罗常数的不确定度被消除
B. 常温常压下,11.2LO2与N2组成的混合气体,含有原子个数小于NA
C. 117号元素符号为Ts(中文名![]() ),其重氢化物D293Ts含有中子数为177NA
),其重氢化物D293Ts含有中子数为177NA
D. 60.0gC3H8O中含有的C-C键可能小于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的NO(g)是导致光化学烟雾和破坏臭氧层的重要源头之一。现拟用下列方法处理NO,根据题意回答下列问题:
(1)采用某种催化剂催化分解NO,发生反应2NO(g)![]() N2(g)+O2(g),在T1℃和T2℃时(T1>T2)NO的转化率随时间变化的结果如图所示。
N2(g)+O2(g),在T1℃和T2℃时(T1>T2)NO的转化率随时间变化的结果如图所示。
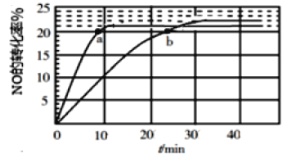
①反应2NO(g)![]() N2(g)+O2(g)为____________(填“吸热”或“放热”)反应。
N2(g)+O2(g)为____________(填“吸热”或“放热”)反应。
②T2℃时,反应的平衡常数K=__________(保留2位小数)。
③在T1℃下,要提高NO转化率,可采取的措施是_________________________
④比较a、b处反应速率大小:υa(正)________υb(逆)(填“大于”“小于”或“等于”)。已知反应速率υ正=k正x2(NO),υ逆=k逆x(N2)·x(O2),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算b点处![]() =__________(保留1位小数)。
=__________(保留1位小数)。
(2)臭氧也可用于处理NO,O3氧化NO结合水洗可产生HNO3和O2,若生成1 mol的HNO3则转移_______ mol电子。
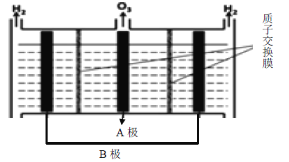
(3)O3可由电解稀硫酸制得,原理如下图所示,图中阴极为________(填“A”或“B”),阳极(惰性电极)的电极反应式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据所学知识回答下列问题:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1_______△H2(填“>”、“<”或“=”,下同)。
(2)已知常温时红磷比白磷稳定,比较下列反应中△H的大小:△H1_______△H2。
①P4(白磷,s)+5O2(g)=2P2O5(s) △H1
②4P(红磷,s)+5O2(g)=2P2O5(s) △H2
(3)已知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量__________57.3kJ。
(4)已知:0.5 mol CH4(g)与0.5 mol水蒸气在t℃、pkPa时,完全反应生成CO和H2的混合气体,吸收了a kJ热量,该反应的热化学方程式是___________________________________。
(5)氨气是一种重要的物质,可用于制取化肥和硝酸等。已知H-H键、N-H键、N≡N键的键能分别是436 kJ·mol-1、391 kJ·mol-1、946 kJ·mol-1。写出合成氨的热反应方程式:___________________________________。生成1 mol NH3需要吸收或放出________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)电解质由强至弱顺序为_________________(用化学式表示,下同)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为 ,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者 后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____________。
(4)NaHSO3溶液显酸性的原因___________________________(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn+)的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
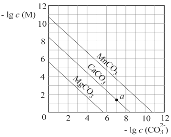
A. Ksp(MnCO3)的数量级为10-11
B. MgCO3的悬浊液中加入少量水充分振荡,c(Mg2+)不变
C. 向浓度均为0.01mol·L-1的Mg2+、Ca2+、Mn2+混合溶液中逐滴加入Na2CO3溶液,最先形成MgCO3沉淀
D. a点表示的溶液中,c(Ca2+)>c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com