
【题目】物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G 的浓溶液中发生钝化, F 的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同)

回答下列问题:
(1)第一种情况:用两根玻璃棒分别蘸取 A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质; D 和 F 的溶液均呈碱性。则:①反应Ⅲ的化学方程式为__________________________。
②D与乙反应的离子方程式为_________________________________________
(2)第二种情况: 甲由两种单质直接化合得到;B 为红棕色固体; C为无色气体,是形成酸雨的大气污染物之一;D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则:
①工业上,反应 I的化学方程式为______________________________________生产设备名称为:__________
②D和乙反应的离子方程式为______________________________________________
③ 请简述检验D溶液中阳离子的方法__________________________________。
④ 若A的相对分子质量为120,反应Ⅰ、Ⅱ、Ⅲ均为完全转化。现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρg/cm3,溶质质量分数为a% 的G溶液n mL。则该样品中A的质量分数=_____________(列出计算式即可)。
【答案】3NO2+H2O=NO+2HNO3 2Al+2OH-+2H2O = 2AlO2-+3H2↑ 4FeS2+11O2![]() 2Fe2O3+8SO2 沸腾炉 2Fe3+ + Fe =3Fe2+ 取少量D溶液于一试管中,向其中滴入1~2滴硫氰化钾溶液,溶液呈现红色、则有三价铁离子
2Fe2O3+8SO2 沸腾炉 2Fe3+ + Fe =3Fe2+ 取少量D溶液于一试管中,向其中滴入1~2滴硫氰化钾溶液,溶液呈现红色、则有三价铁离子 ![]()
【解析】
(1)用两根玻璃棒分别蘸取X和D的浓溶液并使二者靠近时,有大量白烟生成,应为NH3和挥发性酸的反应,由转化关系可知A为NH3,则C为NO,E为NO2,G为HNO3,B为H2O;甲为焰色反应呈黄色的金属单质,应为Na;D和F的溶液均呈碱性,可推知D为NaOH,乙为金属单质,常温下,它在浓硝酸中发生钝化,且与NaOH溶液反应生成F,则乙为Al、F为NaAlO2;
(2)C为无色气体,是形成酸雨的大气污染物之一,则C为SO2,结合转化关系可推知,E为SO3,G为H2SO4.A与氧气反应生成B与二氧化硫,B为红棕色的固体,A的相对分子质量为120,可推知A为FeS2、B为Fe2O3;甲由两种单质直接化合得到,与氧化铁反应生成D,D的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成,含有Cl-,可推知甲为HCl,D为FeCl3,乙为长周期金属单质,常温下,它在浓硫酸中发生钝化,应为Fe,与氯化铁溶液反应生成F,F的溶液中只含有一种溶质,则F为FeCl2。
(1)用两根玻璃棒分别蘸取X和D的浓溶液并使二者靠近时,有大量白烟生成,应为NH3和挥发性酸的反应,由转化关系可知A为NH3,则C为NO,E为NO2,G为HNO3,B为H2O;甲为焰色反应呈黄色的金属单质,应为Na;D和F的溶液均呈碱性,可推知D为NaOH,乙为金属单质,常温下,它在浓硝酸中发生钝化,且与NaOH溶液反应生成F,则乙为Al、F为NaAlO2,则:
①反应Ⅲ的化学方程式为:3NO2+H2O=2HNO3+NO;
②D与乙反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)C为无色气体,是形成酸雨的大气污染物之一,则C为SO2,结合转化关系可推知,E为SO3,G为H2SO4;A与氧气反应生成B与二氧化硫,B为红棕色的固体,A的相对分子质量为120,可推知A为FeS2、B为Fe2O3;甲由两种单质直接化合得到,与氧化铁反应生成D,D的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成,含有Cl-,可推知甲为HCl,D为FeCl3,乙为长周期金属单质,常温下,它在浓硫酸中发生钝化,应为Fe,与氯化铁溶液反应生成F,F的溶液中只含有一种溶质,则F为FeCl2,则:
①工业上,反应I的化学方程式为:4FeS2+11O2![]() 2Fe2O3+8SO2,发生该反应的装置为沸腾炉;
2Fe2O3+8SO2,发生该反应的装置为沸腾炉;
②D和乙反应的离子方程式为:2Fe3++Fe=3Fe2+;
③检验FeCl3溶液中阳离子的方法是:取少许D溶液于试管中,滴加1~2滴硫氰化钾溶液,溶液呈红色,说明含有Fe3+离子;
④令该样品中FeS2的质量分数为y,则:
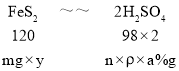
则有,![]() =
=![]() ,解得y=
,解得y=![]() ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】近年来食品安全问题成为社会各界日益关注的焦点话题.香港地区食环署食物安全中心曾对十五个桂花鱼样本进行化验,结果发现十一个样本中含有孔雀石绿。孔雀石绿是化工产品,具有较高毒性,高残留,且长期服用后,容易致癌、致畸,对人体有害。其结构简式如图所示。下列关于孔雀石绿的说法正确的是( )
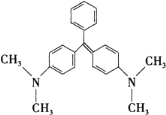
A.孔雀石绿的分子式为C23H25N2
B.1mol孔雀石绿在一定条件下最多可与6molH2发生加成反应
C.孔雀石绿属于芳香烃
D.孔雀石绿苯环上的一氯取代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 代表阿伏加德罗数的数值,下列说法中正确的是
代表阿伏加德罗数的数值,下列说法中正确的是![]()
![]()
A.![]() 的
的![]() 溶液中
溶液中![]() 的数目为
的数目为![]()
B.![]() 分子中碳原子之间共用电子对数为
分子中碳原子之间共用电子对数为![]()
C.电解精炼铜时,若阴极得到电子数为![]() 个,则阳极质量减少64g
个,则阳极质量减少64g
D.标准状况下,![]() 完全溶于水转移电子数为
完全溶于水转移电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中,有关微粒物质的量浓度关系正确的是
A.pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.将100 mL 0.1 mol·L-1 Na2CO3溶液逐滴滴加到100 mL 0.1 mol·L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
C.0.1 mol·L-1(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(H+)>c(Fe2+)
D.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 是阿伏加德罗常数的值,下列说法正确的是
是阿伏加德罗常数的值,下列说法正确的是![]()
![]()
A.![]() 的乙醇溶液中,含
的乙醇溶液中,含![]() 键的数目为
键的数目为![]()
B.标准状况下,![]() 乙炔和苯的混合物中含
乙炔和苯的混合物中含![]() 键数目为
键数目为![]()
C.![]() 溶液中含
溶液中含![]() 数目为
数目为![]()
D.某温度下,![]() 的
的![]() 溶液中,水电离出的
溶液中,水电离出的![]() 总数为
总数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值,下列说法错误的是
A. 等物质的量的Na2O和Na2O2中含有的阴离子数均为NA
B. 常温常压下14gCO和N2的混合气体中含有的原子数为NA
C. 1L1mol/L的亚硫酸溶液中氢离子数小于2NA
D. 18g铝溶于NaOH溶液或盐酸转移电子数均为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向2L的密闭容器中投入一定量的X和Y,在催化剂的作用下发生反应:X(g)+Y(g) 2Z(g)。反应过程中测定的部分数据如下表:
t/min | n(X)/mol | n(Y)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
下列说法正确的是
A.反应0~2min末的平均速率υ(Z)=0.2 mol/(L·min)
B.在2min~4min间,υ(X)正<υ(Y)逆
C.生成2 mol Z的同时消耗1 mol Y能说明该反应已达化学平衡状态
D.其他条件不变,再充入1.2 mol X和0.6 mol Y,X的转化率将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是![]()
![]()
A.![]() 中所含的中子数为
中所含的中子数为![]()
B.36g葡萄糖与果糖的混合物中含有羟基的数目为![]()
C.用惰性电极电解稀硫酸的过程中,溶液的质量每减少![]() 转移电子数为
转移电子数为![]()
D.![]() 和
和![]() 之和为1mol的
之和为1mol的![]() 溶液中.含有的
溶液中.含有的![]() 数目为
数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,用0.100mol· L -1AgNO3溶液滴定50.0mL0.0500mol· L -1NaCl溶液的滴定曲如右图所示[pCl=-lg(Cl-)]。下列有关描述错误的是

A. 室温时Ksp(AgCl)的数量级为10-10
B. 室温时,各点Ksp(AgCl)的关系:a=b=c
C. 相同实验条件下,若改用0.0400mol· L-1 NaCl溶液,反应终点b移动到d
D. 相同实验条件下,若改用0.0500ml· L-1 NaBr溶液,反应终点b向e方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com