
【题目】NA为阿伏伽德罗常数的值,下列说法错误的是
A. 等物质的量的Na2O和Na2O2中含有的阴离子数均为NA
B. 常温常压下14gCO和N2的混合气体中含有的原子数为NA
C. 1L1mol/L的亚硫酸溶液中氢离子数小于2NA
D. 18g铝溶于NaOH溶液或盐酸转移电子数均为2NA
【答案】A
【解析】
A、Na2O是钠离子和O2-构成的离子化合物,Na2O2是钠离子和O22-构成的离子化合物,等物质的量的Na2O和Na2O2中含有的阴离子数相等,但物质的量不一定是1mol,故其含有的阴离子个数相等,但阴离子不一定是NA个,故A错误;
B、CO和氮气的摩尔质量均为28g/mol,故14gCO和N2的混合气体的物质的量为0.5mol,而氮气和CO中均含2个原子,故0.5mol混合气体中含NA个原子,故B正确;
C.1L1mol/L的亚硫酸中含有亚硫酸的物质的量为1mol,亚硫酸是弱酸,在溶液中不能完全电离,故溶液中的氢离子的个数小于2NA个,故C正确;
D、18g铝的物质的量为![]() =
=![]() mol,2Al + 2NaOH +2H2O=2NaAlO2 + 3H2↑,2Al+ 6HCl=2AlCl3+ 3H2↑,反应后铝均变为+3价,故
mol,2Al + 2NaOH +2H2O=2NaAlO2 + 3H2↑,2Al+ 6HCl=2AlCl3+ 3H2↑,反应后铝均变为+3价,故![]() mol铝转移
mol铝转移![]() mol×3=2mol,为2NA个,故D正确;
mol×3=2mol,为2NA个,故D正确;
答案选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
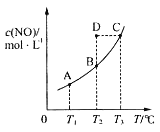
A.该反应的ΔH>0
B.若该反应在T1、T2℃时的平衡常数分别为K1、K2,则K1<K2
C.在T2℃时,若反应体系处于状态D,则此时v正>v逆
D.若状态B、C、D的压强分别为p(B)、p(C)、p(D),则p(C)=p(D)>p(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是

A.该装置工作时,H+由b极区流向a极区
B.该制氢工艺中光能最终转化为化学能
C.a极上发生的电极反应为Fe3++e-=Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.碳酸钙溶于过量的乙酸:CaCO3+2H+=Ca2++CO2↑+H2O
B.氟气与水反应:F2+H2O=H++F-+HFO
C.溴化亚铁溶液中通人少量氯气:2Fe2++C12=2Fe3++2Cl-
D.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G 的浓溶液中发生钝化, F 的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同)

回答下列问题:
(1)第一种情况:用两根玻璃棒分别蘸取 A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质; D 和 F 的溶液均呈碱性。则:①反应Ⅲ的化学方程式为__________________________。
②D与乙反应的离子方程式为_________________________________________
(2)第二种情况: 甲由两种单质直接化合得到;B 为红棕色固体; C为无色气体,是形成酸雨的大气污染物之一;D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则:
①工业上,反应 I的化学方程式为______________________________________生产设备名称为:__________
②D和乙反应的离子方程式为______________________________________________
③ 请简述检验D溶液中阳离子的方法__________________________________。
④ 若A的相对分子质量为120,反应Ⅰ、Ⅱ、Ⅲ均为完全转化。现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρg/cm3,溶质质量分数为a% 的G溶液n mL。则该样品中A的质量分数=_____________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应3A(g)+B(g)![]() 2C(g)+2D(g) ΔH<0,图中,a、b曲线分别表示在不同条件下,A与B反应时,D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采用的措施是
2C(g)+2D(g) ΔH<0,图中,a、b曲线分别表示在不同条件下,A与B反应时,D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采用的措施是

①增大A的浓度 ②升高温度 ③增大D浓度 ④加入催化剂 ⑤恒温下,缩小反应容器体积 ⑥加入稀有气体,保持容器内压强不变
A. ①②③ B. ④⑤ C. ③④⑤ D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知400℃和1.01×105Pa时的气体摩尔体积为55.20 L/mol,在该条件下有1 mol气体X发生如下反应并达到平衡:2X(g)=mY(g)+Z(g),测得平衡混合气中X的体积分数为58.80%,混合气体的总质量为46.00 g,混合气体的密度为0.72 g/L。则平衡混合气体的平均相对分子质量为 ( )
A.58.80B.6.00C.39.74D.16.13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的NO(g)是导致光化学烟雾和破坏臭氧层的重要源头之一。现拟用下列方法处理NO,根据题意回答下列问题:
(1)采用某种催化剂催化分解NO,发生反应2NO(g)![]() N2(g)+O2(g),在T1℃和T2℃时(T1>T2)NO的转化率随时间变化的结果如图所示。
N2(g)+O2(g),在T1℃和T2℃时(T1>T2)NO的转化率随时间变化的结果如图所示。
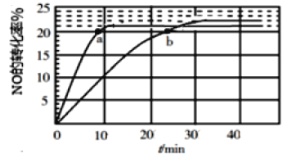
①反应2NO(g)![]() N2(g)+O2(g)为____________(填“吸热”或“放热”)反应。
N2(g)+O2(g)为____________(填“吸热”或“放热”)反应。
②T2℃时,反应的平衡常数K=__________(保留2位小数)。
③在T1℃下,要提高NO转化率,可采取的措施是_________________________
④比较a、b处反应速率大小:υa(正)________υb(逆)(填“大于”“小于”或“等于”)。已知反应速率υ正=k正x2(NO),υ逆=k逆x(N2)·x(O2),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算b点处![]() =__________(保留1位小数)。
=__________(保留1位小数)。
(2)臭氧也可用于处理NO,O3氧化NO结合水洗可产生HNO3和O2,若生成1 mol的HNO3则转移_______ mol电子。
(3)O3可由电解稀硫酸制得,原理如下图所示,图中阴极为________(填“A”或“B”),阳极(惰性电极)的电极反应式为___________________________________。
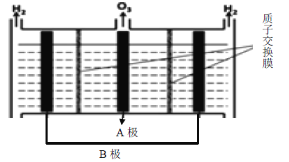
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄是一种常见水果,可以生食或制作葡萄干,除此之外,葡萄还可用于酿酒。
(1)检验葡萄汁含有葡萄糖的方法是:向其中加碱调至碱性,再加入新制的Cu(OH)2并加热,其现象是________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式:C6H12O6(葡萄糖)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)葡萄酒密封储存过程中会生成有香味的酯类,酯类也可以通过化学实验来制备,实验室可用如图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是__________。
②试管b中盛放的试剂是饱和____________溶液。
③实验开始时,试管b中的导管不伸入液面下的原因是________。
④若要分离出试管b中的乙酸乙酯,需要用到的仪器是_______(填字母)。
A.普通漏斗 B.分液漏斗 C.长颈漏斗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com