
【题目】设![]() 代表阿伏加德罗数的数值,下列说法中正确的是
代表阿伏加德罗数的数值,下列说法中正确的是![]()
![]()
A.![]() 的
的![]() 溶液中
溶液中![]() 的数目为
的数目为![]()
B.![]() 分子中碳原子之间共用电子对数为
分子中碳原子之间共用电子对数为![]()
C.电解精炼铜时,若阴极得到电子数为![]() 个,则阳极质量减少64g
个,则阳极质量减少64g
D.标准状况下,![]() 完全溶于水转移电子数为
完全溶于水转移电子数为![]()
【答案】B
【解析】
A.![]() 在溶液中存在平衡:
在溶液中存在平衡:![]() ,故溶液中
,故溶液中![]() 的数目小于
的数目小于![]() ,故A错误;
,故A错误;
B.![]() 分子中每个碳原子最外层有4个电子,每个碳原子中有一个电子与F原子形成一个共用电子对,每个碳原子还剩3个最外层电子,而且剩下的电子由碳原子之间形成共用电子对,且其数目为:
分子中每个碳原子最外层有4个电子,每个碳原子中有一个电子与F原子形成一个共用电子对,每个碳原子还剩3个最外层电子,而且剩下的电子由碳原子之间形成共用电子对,且其数目为:![]() 对,即
对,即![]() 分子中碳原子之间含90mol共用电子对,即为
分子中碳原子之间含90mol共用电子对,即为![]() 对,故B正确;
对,故B正确;
C.电解精炼铜时,阳极是粗铜,粗铜上发生的主要电极反应Cu-2e-=Cu2+,粗铜上比铜活泼的金属杂质也会放电,故阴极得到电子数为![]() 时,即2mol时,阳极减少的质量不一定是64g,故C错误;
时,即2mol时,阳极减少的质量不一定是64g,故C错误;
D.标况下,![]() 氯气的物质的量n=
氯气的物质的量n=![]() =
=![]() =
=![]() ,而氯气与水的反应为歧化反应,1mol氯气参与反应转移1mol电子,但该反应为可逆反应,不能进行彻底,故
,而氯气与水的反应为歧化反应,1mol氯气参与反应转移1mol电子,但该反应为可逆反应,不能进行彻底,故![]() 氯气与水反应转移的电子物质的量小于
氯气与水反应转移的电子物质的量小于![]() ,即小于
,即小于![]() 个电子,故D错误;
个电子,故D错误;
答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值.下列说法正确的是
A.0.2molAl与足量NaOH溶液反应,生成的H2分子数为0.3NA
B.常温下,1LpH=1的盐酸溶液,由水电离的H+离子数目为0.1NA
C.标准状况下,0.1mol氯仿的体积为2.24L
D.11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4反应中,6molCuSO4能氧化白磷的分子数为1.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水淡化的方法有多种,如蒸馏法、电渗析法等。电渗析法是一种利用离子交换膜进行离子交换的方法,其原理如图所示。已知海水中含![]() 、
、![]() 、
、![]() 、
、![]() 、SO等离子,电极为惰性电极。下列叙述中正确的是
、SO等离子,电极为惰性电极。下列叙述中正确的是
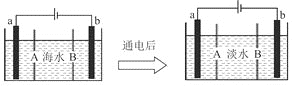
A.B膜是阴离子交换膜
B.通电后,海水中阳离子向a电极处运动
C.通电后,a电极的电极反应式为![]()
D.通电后,b电极上产生无色气体,溶液中出现少量白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
① 写出放电时负极的电极反应式:______________________________;
② 铅蓄电池放电时,溶液的pH将_________(填增大、减小或不变)。当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为___________。
③ 放电完后,对该电池进行充电,在连接电源的负极一端生成________。(填“Pb”或“PbO2”)
(2)下图是某宇宙飞船中使用的氢氧燃料电池。其导电介质为KOH,总反应为:2H2 + O2=2H2O。
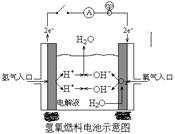
① 则负极通入的是_______,(填“H2”或“O2”)负极电极反应式为:_______________________,正极电极反应式为:______________________。
②如把导电介质改为稀H2SO4,则电极反应式为:负极__________________,正极______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( )
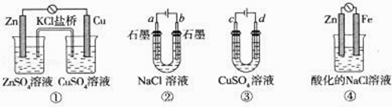
A. 装置①中,盐桥中的K+移向ZnSO4溶液
B. 滴有酚酞溶液的装置②在电解过程中,b极先变红
C. 可以用装置③在铁上镀铜,d极为铜
D. 装置④中发生铁的吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是

A.该装置工作时,H+由b极区流向a极区
B.该制氢工艺中光能最终转化为化学能
C.a极上发生的电极反应为Fe3++e-=Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某溶液中只存在OH-、H+、NH![]() 、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶有一种溶质,则上述四种离子浓度的大小顺序为______(填序号)。
(2)若四种离子的关系符合②,则溶质为________________________。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图像正确的是______(填图像符号)。
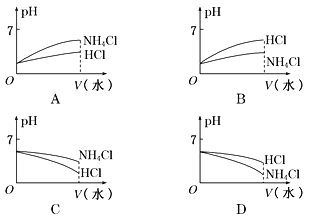
(4) 若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_____________ c(NH3·H2O)(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G 的浓溶液中发生钝化, F 的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同)

回答下列问题:
(1)第一种情况:用两根玻璃棒分别蘸取 A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质; D 和 F 的溶液均呈碱性。则:①反应Ⅲ的化学方程式为__________________________。
②D与乙反应的离子方程式为_________________________________________
(2)第二种情况: 甲由两种单质直接化合得到;B 为红棕色固体; C为无色气体,是形成酸雨的大气污染物之一;D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则:
①工业上,反应 I的化学方程式为______________________________________生产设备名称为:__________
②D和乙反应的离子方程式为______________________________________________
③ 请简述检验D溶液中阳离子的方法__________________________________。
④ 若A的相对分子质量为120,反应Ⅰ、Ⅱ、Ⅲ均为完全转化。现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρg/cm3,溶质质量分数为a% 的G溶液n mL。则该样品中A的质量分数=_____________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据所学知识回答下列问题:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1_______△H2(填“>”、“<”或“=”,下同)。
(2)已知常温时红磷比白磷稳定,比较下列反应中△H的大小:△H1_______△H2。
①P4(白磷,s)+5O2(g)=2P2O5(s) △H1
②4P(红磷,s)+5O2(g)=2P2O5(s) △H2
(3)已知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量__________57.3kJ。
(4)已知:0.5 mol CH4(g)与0.5 mol水蒸气在t℃、pkPa时,完全反应生成CO和H2的混合气体,吸收了a kJ热量,该反应的热化学方程式是___________________________________。
(5)氨气是一种重要的物质,可用于制取化肥和硝酸等。已知H-H键、N-H键、N≡N键的键能分别是436 kJ·mol-1、391 kJ·mol-1、946 kJ·mol-1。写出合成氨的热反应方程式:___________________________________。生成1 mol NH3需要吸收或放出________kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com