
【题目】已知某溶液中只存在OH-、H+、NH![]() 、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶有一种溶质,则上述四种离子浓度的大小顺序为______(填序号)。
(2)若四种离子的关系符合②,则溶质为________________________。
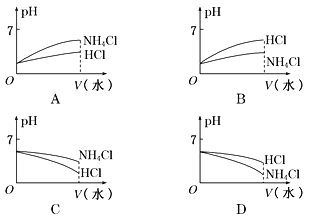
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图像正确的是______(填图像符号)。
(4) 若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_____________ c(NH3·H2O)(填“大于”、“小于”或“等于”)。
【答案】① NH4Cl和NH3·H2O B 小于
【解析】
(1)根据溶液中离子浓度大小的关系,判断溶液中含有的溶质的成分;根据c(H+)和c(OH-)的相对大小,判断溶液的酸碱性;根据稀释促进水解,pH相同的强酸和强酸弱碱盐稀释相同的倍数,强酸的pH变化大,以此进行分析判断图像变化;
(1)已知某溶液中只存在OH-、H+、NH![]() 、Cl-四种离子,若溶液中只溶有一种溶质,则溶质为NH4Cl,由于NH
、Cl-四种离子,若溶液中只溶有一种溶质,则溶质为NH4Cl,由于NH![]() 水解,所以c(Cl-)>c(NH4+),水解使溶液显酸性,所以c(H+)>c(OH-),OH-和H+是由水微弱电离产生的,所以c(Cl-)>c(NH4+)>c(H+)>c(OH-),即四种离子浓度的大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-),所以答案:①
水解,所以c(Cl-)>c(NH4+),水解使溶液显酸性,所以c(H+)>c(OH-),OH-和H+是由水微弱电离产生的,所以c(Cl-)>c(NH4+)>c(H+)>c(OH-),即四种离子浓度的大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-),所以答案:①
(2)若四种离子的关系符合② c(NH4+)>c(OH-)>c(Cl-)>c(H+),说明溶液显碱性,说明一定存在NH3·H2O,同时溶液中存在Cl-,所以是NH4Cl和NH3·H2O的混合液,则溶液的溶质为NH4Cl和NH3·H2O;答案:NH4Cl和NH3·H2O;
(3) NH4Cl为强酸弱碱盐,稀释促进其水解,盐酸为强酸,在溶液中全部电离,pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,PH都增大,且盐酸的pH变化大,所以盐酸的pH大于NH4Cl溶液的pH,所以B项符合题意。答案:B。
(4) 因体积、浓度相同的稀盐酸和氨水混合,溶液中的溶质为NH4Cl,溶液显酸性,而该溶液恰好呈中性,则应为氨水与氯化铵的混合溶液,即c(HC1)<c(NH3·H2O);
故答案为:小于。


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,向1L密闭容器中加入1 mol HI(g),发生反应2HI(g) ![]() H2(g)+I2(g),H2物质的量随时间的变化如图所示。
H2(g)+I2(g),H2物质的量随时间的变化如图所示。

(1)0~2 min内的平均反应速率v(HI)=______________________。 该温度下,H2(g)+I2(g) ![]() 2HI(g)的平衡常数K=________。
2HI(g)的平衡常数K=________。
(2)相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的_______,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为2H2+O2===2H2O,下列有关说法正确的是___________

A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-=4OH-
C.每转移0.1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体![]() ,放电时有关离子转化如图所示.下列说法正确的是
,放电时有关离子转化如图所示.下列说法正确的是
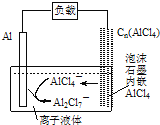
A.放电时,负极发生:![]()
B.放电时,电路中每流过3mol电子,正极减少27g
C.充电时,泡沫石墨极与外电源的负极相连
D.充电时,阴极发生:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 代表阿伏加德罗数的数值,下列说法中正确的是
代表阿伏加德罗数的数值,下列说法中正确的是![]()
![]()
A.![]() 的
的![]() 溶液中
溶液中![]() 的数目为
的数目为![]()
B.![]() 分子中碳原子之间共用电子对数为
分子中碳原子之间共用电子对数为![]()
C.电解精炼铜时,若阴极得到电子数为![]() 个,则阳极质量减少64g
个,则阳极质量减少64g
D.标准状况下,![]() 完全溶于水转移电子数为
完全溶于水转移电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业上采用离子交换膜法电解足量饱和食盐水的示意图。下列有关说法中不正确的是( )
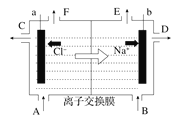
A.从E口逸出的是氢气
B.向B口中加入含少量NaOH的溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH
D.向电解后的阳极室溶液中加入适量盐酸,各物质可以恢复到电解前的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中,有关微粒物质的量浓度关系正确的是
A.pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.将100 mL 0.1 mol·L-1 Na2CO3溶液逐滴滴加到100 mL 0.1 mol·L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
C.0.1 mol·L-1(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(H+)>c(Fe2+)
D.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 是阿伏加德罗常数的值,下列说法正确的是
是阿伏加德罗常数的值,下列说法正确的是![]()
![]()
A.![]() 的乙醇溶液中,含
的乙醇溶液中,含![]() 键的数目为
键的数目为![]()
B.标准状况下,![]() 乙炔和苯的混合物中含
乙炔和苯的混合物中含![]() 键数目为
键数目为![]()
C.![]() 溶液中含
溶液中含![]() 数目为
数目为![]()
D.某温度下,![]() 的
的![]() 溶液中,水电离出的
溶液中,水电离出的![]() 总数为
总数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向2L的密闭容器中投入一定量的X和Y,在催化剂的作用下发生反应:X(g)+Y(g) 2Z(g)。反应过程中测定的部分数据如下表:
t/min | n(X)/mol | n(Y)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
下列说法正确的是
A.反应0~2min末的平均速率υ(Z)=0.2 mol/(L·min)
B.在2min~4min间,υ(X)正<υ(Y)逆
C.生成2 mol Z的同时消耗1 mol Y能说明该反应已达化学平衡状态
D.其他条件不变,再充入1.2 mol X和0.6 mol Y,X的转化率将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个容积均为2L恒温密闭容器中,起始时均充入amolH2S,控制不同温度和分别在有、无Al2O3催化时进行H2S的分解实验[反应为:2H2S(g)![]() 2H2(g)+S2(g)]。测得的结果如下图所示(曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时H2S的转化率)。
2H2(g)+S2(g)]。测得的结果如下图所示(曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时H2S的转化率)。
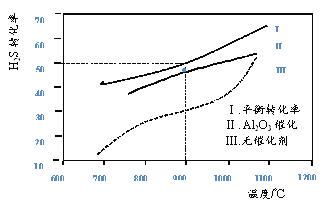
下列说法不正确的是
A. H2S分解为放热反应
B. 加入Al2O3 可提高H2S的平衡转化率
C. 900℃反应2H2S(g)![]() 2H2(g)+S2(g)的平衡常数K=0.125a
2H2(g)+S2(g)的平衡常数K=0.125a
D. 约1100℃曲线Ⅱ、Ⅲ几乎重合,说明Al2O3可能几乎失去催化活性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com