
【题目】25℃时,物质的量浓度均为0.1molL-1的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)用离子方程式解释溶液⑤能去除油污的原因_____。
(2)写出溶液④中通少量CO2的离子方程式:_____。
(3)25℃时,溶液①中,由水电离产生的c(H+)=_____molL﹣1,
(4)①0.100molL-1NH4HCO3溶液中物质的量浓度最大的离子是__________(填化学式);②CH3COOH与NaOH反应后的溶液中存在:c(Na+)<c(CH3COO-),该溶液呈_________性(填“酸”“碱”或“中”),该溶液的溶质是______。(填化学式)
(5)下列说法正确的是_____。
a.c(NH4+):①>②
b.物质的量浓度和体积均相等的NaCl和NaX两种溶液中,离子总数相等
c.等体积的③和⑤形成的混合溶液中:c(HCO3-)+c(CO32-)=0.1molL-1
d.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
(6)某同学欲用0.1molL-1 CaCl2溶液来鉴别溶液③和⑤,当他将CaCl2溶液滴入装有溶液③的试管中时,出现了意想不到的现象:试管中出现了白色沉淀,并伴有气体生成。试解释产生上述现象的原因:_____。
【答案】CO32-+H2O![]() HCO3-+OH- X-+CO2+H2O=HCO3-+HX 10-5 NH4+ 酸 CH3COOH和CH3COONa ad 2HCO3-+Ca2+
HCO3-+OH- X-+CO2+H2O=HCO3-+HX 10-5 NH4+ 酸 CH3COOH和CH3COONa ad 2HCO3-+Ca2+![]() CaCO3+CO2+H2O,c(Ca2+)增大,使平衡向右移动,产生大量白色沉淀和气体
CaCO3+CO2+H2O,c(Ca2+)增大,使平衡向右移动,产生大量白色沉淀和气体
【解析】
(1)油污主要成分是油脂,油脂在碱性条件下水解成可溶的物质,从盐类水解的角度分析;
(2)利用电离平衡常数大的制取电离平衡常数小的进行分析;
(3)利用水的离子积进行分析和判断;
(4)①利用越弱越水解,以及水解程度非常微弱进行分析;
②利用电荷守恒进行分析;
(5)根据盐类水解的原理和弱电解质电离的原理进行分析;
(6)利用反应原理进行分析;
(1)油污的主要成分是油脂,油脂在碱中能水解成可溶的高级脂肪酸钠和甘油,Na2CO3属于强碱弱酸盐,CO32-水解:CO32-+H2O![]() HCO3-+OH-;
HCO3-+OH-;
答案为CO32-+H2O![]() HCO3-+OH-;
HCO3-+OH-;
(2)根据越弱越水解以及表中数据,得出电离出H+能力大小:CH3COOH>H2CO3>HX>HCO3-,因此溶液④中通入少量的CO2,其离子方程式为X-+CO2+H2O=HCO3-+HX;
答案为X-+CO2+H2O=HCO3-+HX;
(3)25℃时,NH4Cl溶液的pH=5,NH4+结合水电离出的OH-,溶液显酸性,由水电离产生的c(H+)水=10-5mol·L-1;
答案为10-5mol·L-1;
(4)①CH3COONH4溶液的pH=7,说明CH3COO-水解能力与NH4+水解能力相同,根据(2)HCO3-水解能力强于NH4+,即该溶液中离子浓度最大的是NH4+;
答案为NH4+;
②反应后溶液中离子有CH3COO-、Na+、H+、OH-,根据电荷守恒有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),因c(Na+)<c(CH3COO-),则有c(H+)>c(OH-),溶液显酸性;此时溶液中的溶质应为CH3COOH和CH3COONa;
答案为酸;CH3COOH和CH3COONa;
(5)a、CH3COONH4属于弱酸弱碱盐,CH3COO-和NH4+互相促进水解,因此相同浓度时,c(NH4+):①>②,故a正确;
b、根据电荷守恒,NaCl溶液中存在c(Na+)+c(H+)=c(Cl-)+c(OH-),NaX溶液中:c(Na+)+c(H+)=c(X-)+c(OH-),比较离子总数大小,只要比较阳离子浓度和,又因为NaCl和NaX物质的量浓度和体积相同,即c(Na+)相同,即比较离子总数大小,只需要比较c(H+),NaCl溶液显中性,NaX溶液显碱性,因此前者c(H+)大于后者,即两者离子总数不相等,故b错误;
c、等体积③和⑤混合,根据物料守恒,因此有c(HCO3-)+c(H2CO3)+c(CO32-)=0.1mol/l,故c错误;
d、根据上述分析,CH3COOH的酸性强于HX,因此pH相同时稀释相同倍数,HX溶液的pH变化小,故d正确;
答案为ad;
(6)根据实验现象,得出2HCO3-+Ca2+![]() CaCO3+CO2+H2O,c(Ca2+)增大,使平衡向右移动,产生大量白色沉淀和气体;
CaCO3+CO2+H2O,c(Ca2+)增大,使平衡向右移动,产生大量白色沉淀和气体;
答案为2HCO3-+Ca2+![]() CaCO3+CO2+H2O,c(Ca2+)增大,使平衡向右移动,产生大量白色沉淀和气体。
CaCO3+CO2+H2O,c(Ca2+)增大,使平衡向右移动,产生大量白色沉淀和气体。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.碳酸钙溶于过量的乙酸:CaCO3+2H+=Ca2++CO2↑+H2O
B.氟气与水反应:F2+H2O=H++F-+HFO
C.溴化亚铁溶液中通人少量氯气:2Fe2++C12=2Fe3++2Cl-
D.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的NO(g)是导致光化学烟雾和破坏臭氧层的重要源头之一。现拟用下列方法处理NO,根据题意回答下列问题:
(1)采用某种催化剂催化分解NO,发生反应2NO(g)![]() N2(g)+O2(g),在T1℃和T2℃时(T1>T2)NO的转化率随时间变化的结果如图所示。
N2(g)+O2(g),在T1℃和T2℃时(T1>T2)NO的转化率随时间变化的结果如图所示。
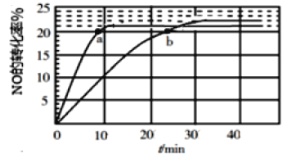
①反应2NO(g)![]() N2(g)+O2(g)为____________(填“吸热”或“放热”)反应。
N2(g)+O2(g)为____________(填“吸热”或“放热”)反应。
②T2℃时,反应的平衡常数K=__________(保留2位小数)。
③在T1℃下,要提高NO转化率,可采取的措施是_________________________
④比较a、b处反应速率大小:υa(正)________υb(逆)(填“大于”“小于”或“等于”)。已知反应速率υ正=k正x2(NO),υ逆=k逆x(N2)·x(O2),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算b点处![]() =__________(保留1位小数)。
=__________(保留1位小数)。
(2)臭氧也可用于处理NO,O3氧化NO结合水洗可产生HNO3和O2,若生成1 mol的HNO3则转移_______ mol电子。
(3)O3可由电解稀硫酸制得,原理如下图所示,图中阴极为________(填“A”或“B”),阳极(惰性电极)的电极反应式为___________________________________。
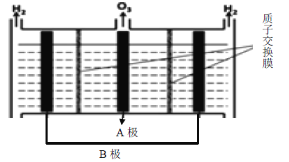
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数值。下列有关叙述正确的是
为阿伏加德罗常数值。下列有关叙述正确的是![]()
![]()
A.电解精炼粗铜![]() 含有锌铁等杂质
含有锌铁等杂质![]() ,若阳极溶解32g铜,转移电子数目为
,若阳极溶解32g铜,转移电子数目为![]()
B.![]() 分子结构如图
分子结构如图![]() 含
含![]() 键数为
键数为![]()

C.某温度下,![]() 的
的![]() 溶液中含有的
溶液中含有的![]() 数目为
数目为![]()
D.氢氧燃料电池正极消耗![]() 气体时,负极消耗的气体分子数目为
气体时,负极消耗的气体分子数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)电解质由强至弱顺序为_________________(用化学式表示,下同)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为 ,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者 后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____________。
(4)NaHSO3溶液显酸性的原因___________________________(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。

(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄是一种常见水果,可以生食或制作葡萄干,除此之外,葡萄还可用于酿酒。
(1)检验葡萄汁含有葡萄糖的方法是:向其中加碱调至碱性,再加入新制的Cu(OH)2并加热,其现象是________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式:C6H12O6(葡萄糖)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)葡萄酒密封储存过程中会生成有香味的酯类,酯类也可以通过化学实验来制备,实验室可用如图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是__________。
②试管b中盛放的试剂是饱和____________溶液。
③实验开始时,试管b中的导管不伸入液面下的原因是________。
④若要分离出试管b中的乙酸乙酯,需要用到的仪器是_______(填字母)。
A.普通漏斗 B.分液漏斗 C.长颈漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol![]() 和2mol
和2mol![]() ,开始时容器的体积均为VL,发生如下反应并达到平衡状态
,开始时容器的体积均为VL,发生如下反应并达到平衡状态![]() 提示:物质X,Y的状态均未知,物质Z的状态为气态),2X(?)+Y(?)
提示:物质X,Y的状态均未知,物质Z的状态为气态),2X(?)+Y(?)![]() aZ(g)此时Ⅰ中X,Y,Z的物质的量之比为1:3:2。下列判断正确的是
aZ(g)此时Ⅰ中X,Y,Z的物质的量之比为1:3:2。下列判断正确的是![]()
![]()
Ⅰ Ⅱ
Ⅱ Ⅲ
Ⅲ
A.物质Z的化学计量数 a= 2
B.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ
C.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com