
科目: 来源: 题型:
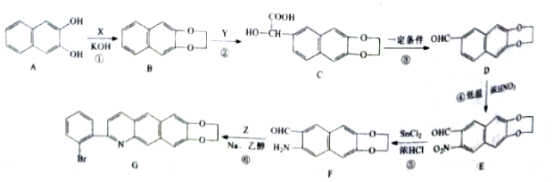
【题目】有机物J是一种医药中间体,可通过如下图示路线合成。

已知:![]()
请回答以下问题:
(1)B的结构简式是___________,D的结构简式是___________。
(2)在一定条件下,两个F分子发生分子间脱水生成一种环状酯,该环状酯的结构简式为_______。
(3)A与足量的银氨溶液溶液反应的化学方程式是_________。
(4)J与足量的氢氧化钠溶液反应的化学方程式是__________。
(5)满足以下条件的G的同分异构体(不含G)共有________种;
①含有酯基; ②能与氯化铁溶液发生显色反应
查看答案和解析>>
科目: 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,2molNO和1molO2反应后分子总数为2NA
B.1mol铁在1mol氯气中燃烧,转移的电子数为3NA
C.在标准状况下,4.48L甲烷的氯代物分子含原子数目为NA
D.一定条件下,2.3gNa与O2完全反应生成3.6g产物时失去的电子数0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、CaO等杂质),钙化法焙烧制备V2O5,其流程如下:
![]()
资料:+5价钒在溶液中的主要存在形式与溶液pH的关系:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO2+ | VO3— | V2O74— | VO43— |
(1)焙烧:向石煤中加生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式是_________。
(2)酸浸:①Ca(VO3)2难溶于水,可溶于盐酸。若焙砂酸浸时溶液的pH=4,Ca(VO3)2溶于盐酸的离子方程式是________。
②酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约3.2%,根据下图推测,酸浸时不选择更高酸度的原因是________。

(3)转沉:将浸出液中的钒转化为NH4VO3固体,其流程如下:
![]()
①浸出液中加入石灰乳的作用是_____________。
②已知常温下CaCO3的溶度积常数为Ksp1,Ca3(VO4)2溶度积常数为Ksp2。过滤后的(NH4)3VO4溶液中VO43—的浓度为cmol/L,该溶液中CO32—的浓度为_______mol/L
③向(NH4)3VO4溶液中加入NH4Cl溶液,控制溶液的pH=7.5。当pH>8时,NH4VO3的产量明显降低,原因是_______________。
(4)测定产品中V2O5的纯度:称取ag产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1mLc1mol/L(NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+=VO2++Fe3++H2O)最后用c2mol/LKMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。
已知MnO4-被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是_____。(V2O5的摩尔质量:182g/mol)
查看答案和解析>>
科目: 来源: 题型:
【题目】三草酸合铁(III)酸钾K3[Fe
(C
2O4)3]3H2O(其相对分子质量为491),为绿色晶体,易溶于水,难溶于酒精。110℃下可完全失去结晶水,230℃时分解。它还具有光敏性,光照下即发生分解,是制备活性铁催化剂的原料。某化学小组制备该晶体,并测定其中铁的含量,进行如下实验:
Ⅰ.三草酸合铁(Ⅲ)酸钾的制备;
①称取5g硫酸亚铁固体,放入到100mL的烧杯中,然后加15mL馏水和5~6滴稀硫酸,加热溶解后,再加入25mL饱和草酸溶液,搅拌加热至沸。停止加热,静置,待析出固体后,抽滤、洗涤、干燥,得到FeC2O42H2O;
②向草酸亚铁固体中加入饱和K2C2O4溶液10mL,40oC水浴加热,边搅拌边缓慢滴加20mL3%H2O2溶液,变为深棕色,检验Fe2+是否完全转化为Fe3+,若氧化不完全,再补加适量的H2O2溶液;
③将溶液加热至沸,然后加入20mL饱和草酸溶液,沉淀立即溶解,溶液转为绿色。趁热抽滤,滤液转入100mL烧杯中,加入95%乙醇25mL,混匀后冷却,可以看到烧杯底部有晶体析出。晶体完全析出后,抽滤,用乙醇-丙酮混合液洗涤,置于暗处晾干即可。
(1)写出步骤①中,生成FeC2O42H2O晶体的化学方程式___。检验FeC2O42H2O晶体是否洗涤干净的方法是___。
(2)步骤②中检验Fe2+是否完全转化的操作为___。
(3)步骤③用乙醇-丙酮混合液洗涤,而不是用蒸馏水洗涤的原因是___。
Ⅱ.铁含量的测定:
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化,MnO4-被还原成Mn2+,向反应后的溶液中逐渐加入锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.0100mol/LKMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+。
步骤四:重复步骤二、步骤三操作,滴定消耗0.0100mol/LKMnO4溶液19.98mL。
(4)配制三草酸合铁酸钾溶液中用到的玻璃仪器有烧杯____,___,___。
(5)写出步骤三中发生反应的离子方程式____。
(6)实验测得该晶体中铁的质量分数为____(结果保留3位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G是一种具有抗痢疾的某种药物的中间体,其合成路线如图:
已知:![]() +R3NH2
+R3NH2![]() +H2O
+H2O
(1)X的分子式为C2H4Cl2,写出其化学名称____。
(2)①的反应类型为____。
(3)D中官能团的名称为____。
(4)E的分子式为____。
(5)芳香族化合物Z的分子式为C8H7OBr,写出Z的结构简式____。
(6)同时满足下列条件的D的同分异构体有多种,写出任意一种的结构简式____。
①能与氯化铁发生显色反应
②能与纯碱反应放出二氧化碳气体
③除苯环外无其他环状结构
④核磁共振氢谱为四组峰,峰面积比为1:1:2:6
(7)写出![]() 和
和 为有机原料制备
为有机原料制备![]() 的流程图。____
的流程图。____
查看答案和解析>>
科目: 来源: 题型:
【题目】镍铬钢俗称不锈钢,在日常生活中应用广泛,含有铁、铬、镍、碳等元素。
请回答下列问题:
(1)镍的基态原子核外价层电子排布式为_______________,基态Fe3+有_____种不同运动状态的电子,基态铬原子有__________个未成对电子。
(2)配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是_______________(填元素符号),铬的高价化合物可将CH3CH2OH 氧化为CH3CHO,CH3CHO 中—CH3和—CHO 中碳原子的杂化方式分别为_______________、___________________。
(3)镍能与CO 形成Ni(CO)4,常温下Ni(CO)4是无色液体,易溶于有机溶剂,推测Ni(CO)4是__________晶体,组成Ni(CO)4的三种元素电负性由大到小的顺序为_______________(填元素符号),CO 分子中π键与σ键的个数比为_______________。
(4)NiO 的立方晶体结构如图所示,则O2-填入Ni2+构成的________空隙(填“正四面体”、“正八面体”、“ 立方体”或“压扁八面体”)。NiO晶体的密度为ρg·cm-3,Ni2+和O2-的半径分别为r1pm和r2pm,阿伏加德罗常数值为NA,则该晶胞中原子的体积占晶胞体积的百分率为___________________________________。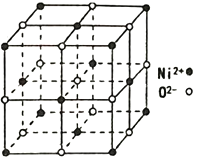
查看答案和解析>>
科目: 来源: 题型:
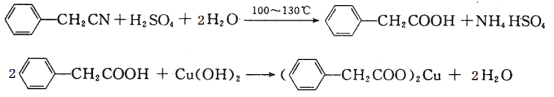
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体。下面是它的一种实验室合成路线:
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
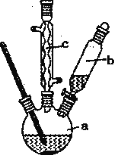
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
实验步骤:
Ⅰ.制苯乙酸粗品
在250 mL三颈瓶a中加入70 mL70%硫酸,加入碎瓷片,将a中的溶液加热至100 ℃,通过仪器b缓缓滴加40 g 苯乙腈到硫酸溶液中,然后升温至130℃继续反应。反应结束后加适量冷水,立即析出苯乙酸晶体,再分离出苯乙酸粗品。
Ⅱ.提纯苯乙酸 Ⅲ.制苯乙酸铜
将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。
回答下列问题:
(1)配制70%硫酸时,加入蒸馏水与浓硫酸的先后顺序是_____________。
(2)加入碎瓷片的作用是____________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是____________(填答案标号)。
A 立即补加 B 冷却后补加 C 不需补加 D 重新配料实验
(3)仪器c的名称是 ______ ,其作用是__________ 。
(4)下列仪器中,不能用于分离苯乙酸粗品的是____________ (填标号) 。
A 蒸馏烧瓶 B 漏斗 C 烧杯 D 直形冷凝管 E 玻璃棒
(5)提纯粗苯乙酸操作的方法名称是_____ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂的固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2等。利用该固体废渣制取Cu (NO3)2的部分工艺流程如图所示:

(1)Cu与稀硝酸反应的离子方程式为 。
(2)酸溶时,反应温度不宜超过70℃,其主要原因是 ,若保持反应温度为70℃,欲加快反应速率可采取的措施为 (写2种)。
(3)过滤后所得废渣的主要成分的化学式为 。
(4)由Cu(NO3)2溶液制Cu(NO3)2晶体的操作方法是:蒸发浓缩、 、过滤、冰水洗涤、低温烘干。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气既是一种清洁能源,又是一种化工原料,在国民经济中发挥着重要的作用。
(1)氢气是制备二甲醚的原料之一,可通过以下途径制取:
Ⅰ.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) △H
Ⅱ.2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) △H
已知:①CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=akJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g) △H2=bkJmol-1
③CH3OCH3(g)+H2O(g)2CH3OH(g) △H3=ckJmol-1
则反应Ⅱ的△H____kJmol-1
(2)氢气也可以和CO2在催化剂(如Cu/ZnO)作用下直接生成CH3OH,方程式如下CO2(g)+3H2(g)CH3OH(g)+H2O(g),现将1molCO2(g)和3molH2(g)充入2L刚性容器中发生反应,相同时间段内测得CH3OH的体积分数φ (CH3OH)与温度(T)的关系如图所示:
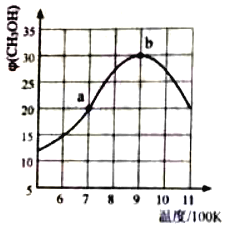
①经过10min达到a点,此时CH3OH的体积分数为20%.则v(H2)=___(保留三位小数)。
②b点时,CH3OH的体积分数最大的原因是___。
③b点时,容器内平衡压强为 P0,CH3OH的体积分数为30%,则反应的平衡常数Kp=___(用平衡分压代替平衡浓度计算,分压=总压×体积分数)
④a点和b点的v逆,a__b(填“>”“<”或”=”)若在900K时,向此刚性容器中再充入等物质的量的CH3OH和H2O,达平衡后φ(CH3OH)___30%。
⑤在900K及以后,下列措施能提高甲醇产率的是____(填字母)
a.充入氦气 b.分离出H2O c.升温 d.改变催化剂
(3)H2还可以还原NO消除污染,反应为2NO(g)+2H2(g)N2(g)+2H2O(g),该反应速率表达式v=kc2(NO)c(H2)(k是速率常数,只与温度有关),上述反应分两步进行:
i.2NO(g)+H2(g)N2(g)+H2O2(g)△H1;ii.H2O2(g)+H2(g)2H2O(g)△H2化学总反应分多步进行,反应较慢的一步控制总反应速率,上述两步反应中,正反应的活化能较低的是___(填“i”或“ii”)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000 mol·L-1某酸(HA)溶液,溶液中HA、A-的物质的量分数δ(X)随pH的变化如图所示。[已知δ(X)=![]() ]下列说法正确的是
]下列说法正确的是
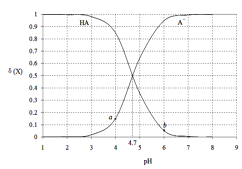
A.Ka(HA)的数量级为10-5
B.溶液中由水电离出的c(H+):a点>b点
C.当pH=4.7时,c(A-)+c(OH-)=c(HA)+c(H+)
D.当pH=7时,消耗NaOH溶液的体积为20.00mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com