
【题目】有机物J是一种医药中间体,可通过如下图示路线合成。

已知:![]()
请回答以下问题:
(1)B的结构简式是___________,D的结构简式是___________。
(2)在一定条件下,两个F分子发生分子间脱水生成一种环状酯,该环状酯的结构简式为_______。
(3)A与足量的银氨溶液溶液反应的化学方程式是_________。
(4)J与足量的氢氧化钠溶液反应的化学方程式是__________。
(5)满足以下条件的G的同分异构体(不含G)共有________种;
①含有酯基; ②能与氯化铁溶液发生显色反应
【答案】CH3COOH ![]()
![]() CH3CHO + 2Ag(NH3)2OH
CH3CHO + 2Ag(NH3)2OH![]() CH3COONH4 + 2Ag↓+ 3NH3 + H2O
CH3COONH4 + 2Ag↓+ 3NH3 + H2O 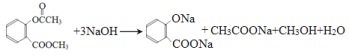 18
18
【解析】
由合成流程可知,CH2=CH2氧化生成A为CH3CHO,A氧化生成B为CH3COOH,B发生取代反应生成C;结合F、J的结构可知,F发生酯化反应生成G,G为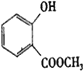 ,则甲苯发生取代反应生成D为
,则甲苯发生取代反应生成D为![]() ,D发生氧化反应生成E,E发生水解反应得到F(邻醛基苯甲酸),F与甲醇发生酯化反应得到G,以此来解答。
,D发生氧化反应生成E,E发生水解反应得到F(邻醛基苯甲酸),F与甲醇发生酯化反应得到G,以此来解答。
(1)根据分析可知B的结构简式是CH3COOH,D的结构简式是![]() ,故答案为:CH3COOH;
,故答案为:CH3COOH;![]() ;
;
(2)在一定条件下,两个F分子发生分子间脱水生成一种环状酯,该环状酯的结构简式为 ,故答案为:
,故答案为: ;
;
(3)A为CH3CHO,醛基可以被银氨溶液氧化,所以A与足量的银氨溶液溶液反应的化学方程式是CH3CHO + 2Ag(NH3)2OH![]() CH3COONH4 + 2Ag↓+ 3NH3 + H2O,故答案为:CH3CHO + 2Ag(NH3)2OH
CH3COONH4 + 2Ag↓+ 3NH3 + H2O,故答案为:CH3CHO + 2Ag(NH3)2OH![]() CH3COONH4 + 2Ag↓+ 3NH3 + H2O;
CH3COONH4 + 2Ag↓+ 3NH3 + H2O;
(4)J中含有酯基,可以在氢氧化钠溶液中发生水解,水解产物中含有酚羟基,也可以氢氧化钠发生反应,所以J与足量的氢氧化钠溶液反应的化学方程式是 ,故答案为:
,故答案为: ;
;
(5)G为![]() ,①含有酯基;②能与氯化铁溶液发生显色反应,则一定含酚-OH,苯环上有两个取代基,为-OH、-COOCH3,或-OH、-OOCCH3,或-OH、-CH2OOCH,均存在邻、间、对位置,有3×3-1=8种;若含3个取代基,分别为-OH、-OOCH、CH3、两个取代基为邻位时-COOH有4种位置,两个取代基为间位时-COOH有4种位置,两个取代基为对位时-COOH有2种位置,共4+4+2=10种,满足以下条件的G的同分异构体(不含G)共有8+10=18种,故答案为:18。
,①含有酯基;②能与氯化铁溶液发生显色反应,则一定含酚-OH,苯环上有两个取代基,为-OH、-COOCH3,或-OH、-OOCCH3,或-OH、-CH2OOCH,均存在邻、间、对位置,有3×3-1=8种;若含3个取代基,分别为-OH、-OOCH、CH3、两个取代基为邻位时-COOH有4种位置,两个取代基为间位时-COOH有4种位置,两个取代基为对位时-COOH有2种位置,共4+4+2=10种,满足以下条件的G的同分异构体(不含G)共有8+10=18种,故答案为:18。


科目:高中化学 来源: 题型:
【题目】![]() (主要指NO和
(主要指NO和![]() )是大气主要污染物之一。有效去除大气中的
)是大气主要污染物之一。有效去除大气中的![]() ,是环境保护的重要课题。
,是环境保护的重要课题。
(1)用稀硝酸吸收![]() ,得到
,得到![]() 和
和![]() 的混合溶液,惰性电极电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:______________________________________。
的混合溶液,惰性电极电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:______________________________________。
(2)在有氧条件下,新型催化剂M能催化![]() 与
与![]() 反应生成
反应生成![]() 。
。
①写出![]() 与
与![]() 反应方程式__________________________________________。
反应方程式__________________________________________。
②将一定比例的![]() 、
、![]() 和
和![]() 的混合气体,匀速通入装有催化剂M的反应器中反应(如图-1所示)
的混合气体,匀速通入装有催化剂M的反应器中反应(如图-1所示)
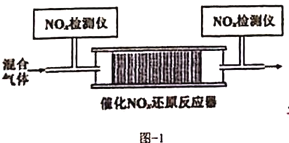

反应相同时间![]() 的去除率随反应温度的变化曲线如图-2所示,在50~150℃范围内随着温度的升高,
的去除率随反应温度的变化曲线如图-2所示,在50~150℃范围内随着温度的升高,![]() 的去除率迅速上升的主要原因是_____________________________,150~380℃范围
的去除率迅速上升的主要原因是_____________________________,150~380℃范围![]() 的去除率上升缓慢的主要原因是_____________________________。当反应温度高于380℃时,
的去除率上升缓慢的主要原因是_____________________________。当反应温度高于380℃时,![]() 的去除率迅速下降的原因可能是:_____________________________;_____________________________。
的去除率迅速下降的原因可能是:_____________________________;_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废水中含有Mg2+、NH4+、Na+、SO42-和NO3-,某工厂采用电渗析法处理废水获得化工品。模拟装置如图所示(废水进、出口省略)。下列说法正确的是( )
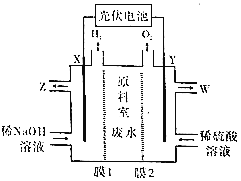
A.膜1交换阴离子,膜2交换阳离子
B.理论上交换的阳离子与阴离子数目相同
C.X极的反应式为2H2O+2e-═2OH-+H2↑
D.W处流出的溶液含1种溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如下图所示。下列说法不正确的是( )
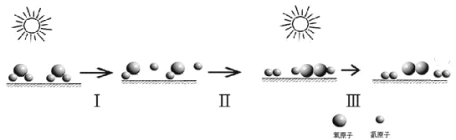
A.整个过程实现了光能向化学能的转换
B.过程Ⅱ有O-O单键生成并放出能量
C.过程Ⅲ发生的化学反应为:2H2O2═2H2O+O2
D.整个过程的总反应方程式为:2H2O→2H2+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍铬钢俗称不锈钢,在日常生活中应用广泛,含有铁、铬、镍、碳等元素。
请回答下列问题:
(1)镍的基态原子核外价层电子排布式为_______________,基态Fe3+有_____种不同运动状态的电子,基态铬原子有__________个未成对电子。
(2)配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是_______________(填元素符号),铬的高价化合物可将CH3CH2OH 氧化为CH3CHO,CH3CHO 中—CH3和—CHO 中碳原子的杂化方式分别为_______________、___________________。
(3)镍能与CO 形成Ni(CO)4,常温下Ni(CO)4是无色液体,易溶于有机溶剂,推测Ni(CO)4是__________晶体,组成Ni(CO)4的三种元素电负性由大到小的顺序为_______________(填元素符号),CO 分子中π键与σ键的个数比为_______________。
(4)NiO 的立方晶体结构如图所示,则O2-填入Ni2+构成的________空隙(填“正四面体”、“正八面体”、“ 立方体”或“压扁八面体”)。NiO晶体的密度为ρg·cm-3,Ni2+和O2-的半径分别为r1pm和r2pm,阿伏加德罗常数值为NA,则该晶胞中原子的体积占晶胞体积的百分率为___________________________________。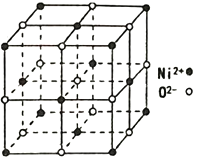
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
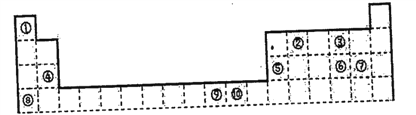
(1)写出元素⑤的原子轨道表示式______________。
(2)写出元素⑨的基态原子的价电子排布式_________。
(3)表中属于ds区的元素是_________(填编号)
(4)元素⑩形成的单质是由____键形成的晶体,该晶体采取的堆积方式是_______,晶体中⑩元素原子的配位数是_________。
(5)元素④、⑤、⑥、⑦的离子半径由小到大的顺序是_______(用离子符号表示)
(6)写出元素①和元素⑧形成化合物的电子式_________________。
(7)元素⑨与⑩的第二电离能分别为:I⑨=1753kJ/mo1,I⑩=1959kJ/mo1,第二电离能I⑨⑩的原因是____________________________。
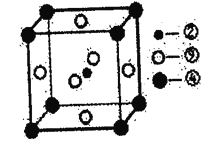
(8)科学家发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如下图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为______(用对应的元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的氧化物对环境的影响较大,CO是燃煤工业生产中的大气污染物,CO2则促进了地球的温室效应。给地球生命带来了极大的威胁。
(1)已知:①甲醇的燃烧热△H=-726.4kJ·mol-1
②H2(g)+ ![]() O2(g)=H2O(l) △H=-285.8kJ·mol-1。
O2(g)=H2O(l) △H=-285.8kJ·mol-1。
则二氧化碳和氢气合成液态甲醇,生成液态水的热化学方程式为_____________________________。
(2)二氧化碳合成CH3OH 的热化学方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1,过程中会产生副反应:CO2(g)+H2(g)
CH3OH(g)+H2O(g)△H1,过程中会产生副反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2。图1是合成甲醇反应中温度对CH3OH、CO的产率影响曲线图,△H2________0(填“>”或“<”)。增大反应体系的压强,合成甲醇的反应速率___________(填“增大”“减小”或“ 不变”),副反应的化学平衡________(填“向正反应方向”“向逆反应方向”或“不”)移动。
CO(g)+H2O(g)△H2。图1是合成甲醇反应中温度对CH3OH、CO的产率影响曲线图,△H2________0(填“>”或“<”)。增大反应体系的压强,合成甲醇的反应速率___________(填“增大”“减小”或“ 不变”),副反应的化学平衡________(填“向正反应方向”“向逆反应方向”或“不”)移动。
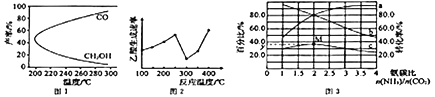
(3)以某些过渡金属氧化物作催化剂,二氧化碳与甲烷可转化为乙酸:CO2(g) +CH4(g)![]() CH3COOH(g) △H=+36.0kJ·mol-1。不同温度下,乙酸的生成速率变化曲线如图2。结合反应速率,使用催化剂的最佳温度是________℃,欲提高CH4的转化率,请提供一种可行的措施:____________________________。
CH3COOH(g) △H=+36.0kJ·mol-1。不同温度下,乙酸的生成速率变化曲线如图2。结合反应速率,使用催化剂的最佳温度是________℃,欲提高CH4的转化率,请提供一种可行的措施:____________________________。
(4)一定条件下,CO2 与NH3 可合成尿素[CO(NH2)2]:CO2(g)+2NH3(g)![]() CO(NH2)2(g)+H2O(g)△H。某温度下。在容积为1L的恒容密闭容器中,加入一定氨碳比
CO(NH2)2(g)+H2O(g)△H。某温度下。在容积为1L的恒容密闭容器中,加入一定氨碳比![]() 的3molCO2 和NH3的混合气体。图3是有关量的变化曲线,其中表示NH3转化率的是曲线________(填“a”或“b”),曲线c 表示尿素在平衡体系中的体积分数变化曲线,则M点的平衡常数K=________,y=________。
的3molCO2 和NH3的混合气体。图3是有关量的变化曲线,其中表示NH3转化率的是曲线________(填“a”或“b”),曲线c 表示尿素在平衡体系中的体积分数变化曲线,则M点的平衡常数K=________,y=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铜萃取剂M,通过如下反应实现铜离子的富集:

(1)X难溶于水、易溶于有机溶剂,其晶体类型为________。
(2)M所含元素的电负性由大到小顺序为_______,N原子以_____轨道与O原子形成σ键。
(3)上述反应中断裂和生成的化学键有______(填序号)。
a.离子键
b.配位键
c.金属键
d.范德华力
e.共价键
(4)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是_____。

(5)基态Cu2+的外围电子排布式为________,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是___________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物广泛应用于生活、生产、国防等领域。
(1)已知:元素的一个基态的气态原子得到一个电子形成-1价气态阴离子时所放出的能量称为该元素的第一电子亲和能,用E1表示。从-1价的气态阴离子再得到1个电子,成为-2价的气态阴离子所放出的能量称为第二电子亲和能E2,依此类推。FeO是离子晶体,其晶格能可通过如下的Born-Haber循环计算得到。
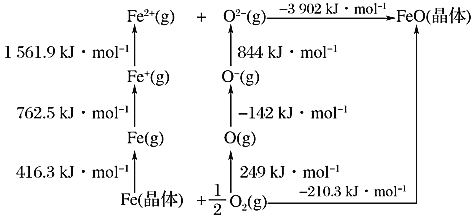
铁单质的原子化热为__________kJ/mol,FeO的晶格能为__________kJ/mol,基态O原子E1____________E2(填“大于”或“小于”),从原子结构角度解释_________。
(2)乙二胺四乙酸又叫做EDTA(图1),是化学中一种良好的配合剂,形成的配合物叫做螯合物。EDTA在配位滴定中经常用到,一般是测定金属离子的含量。已知:EDTA配离子结构(图2)。
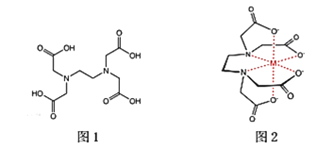
EDTA中碳原子轨道的杂化类型为____________,EDTANa-Fe(Ⅲ)是一种螯合物,六个配位原子在空间构型为____________。EDTANa-Fe(Ⅲ)的化学键除了σ键和配位键外,还存在____________。
(3)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O 围成的正四面体空隙和如3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,O2-数与正四面体空隙数(包括被填充的)之比为__________,有__________%的正八面体空隙填充阳离子。Fe3O4晶胞的八分之一是图示结构单元(图3),晶体密度为5.18 g/cm3,则该晶胞参数a=____________pm。(写出计算表达式)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com