
【题目】某废水中含有Mg2+、NH4+、Na+、SO42-和NO3-,某工厂采用电渗析法处理废水获得化工品。模拟装置如图所示(废水进、出口省略)。下列说法正确的是( )
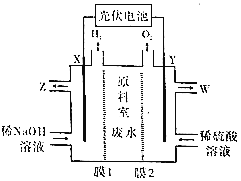
A.膜1交换阴离子,膜2交换阳离子
B.理论上交换的阳离子与阴离子数目相同
C.X极的反应式为2H2O+2e-═2OH-+H2↑
D.W处流出的溶液含1种溶质
【答案】C
【解析】
X电解氢氧化钠溶液,放出氢气,则X为阴极,Y电极电解稀硫酸放出氧气,Y为阳极;电解池中阳离子向阴极移动,阴离子向阳极移动,据此分析解答。
A.水发生还原反应放出H2,说明X极为阴极,阳离子向X极迁移,阴离子向Y极迁移,膜1为阳离子交换膜,膜2为阴离子交换膜,故A错误;
B.理论上,交换的阳离子所带正电荷总数与阴离子所带负电荷总数相等,而离子总数不一定相等,故B错误;
C.X极为阴极,发生反应为2H2O+2e-=2OH-+H2↑,Y极为阳极,发生反应为2H2O-4e-=4H+ +O2↑,故C正确;
D.SO42-和NO3-向Y电极移动,则W处流出的溶液含有HNO3和H2SO4,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如下图所示。下列有关该有机物说法正确的是
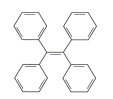
A. 分子式为C26H22 B. 属于苯的同系物
C. 一氯代物有3种 D. 能溶于水和酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2+能与NH3、H2O、OH﹣、Cl﹣等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2+中的配位键__。
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有__(填序号)。
A.离子键 B.金属键 C.极性共价键 D.非极性共价键
(2)金属铜单独与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生如下反应:Cu+H2O2+4NH3═[Cu(OH)4]2++2OH﹣。其原因是_________________.
(3)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图):

①H、O、N三种元素的电负性从大到小的顺序____。
②乙二胺分子中N原子成键时采取的杂化类型是__。
③乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸乙酯(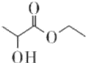 )是一种食用香料,常用于调制果香型、乳酸型食用和酒用精。乳酸乙酯的同分异构体M有如下性质:0.1mol M分别与足量的金属钠和碳酸氢钠反应,产生的气体在相同状况下的体积相同,则M的结构最多有(不考虑空间异构)
)是一种食用香料,常用于调制果香型、乳酸型食用和酒用精。乳酸乙酯的同分异构体M有如下性质:0.1mol M分别与足量的金属钠和碳酸氢钠反应,产生的气体在相同状况下的体积相同,则M的结构最多有(不考虑空间异构)
A. 8种B. 9种C. 10种D. 12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)烷烃A的碳原子数是5,则符合A的结构有____________ 种,其中含有四个甲基的系统命名为________________________________ ;
(2)烷烃B在同温同压下蒸气的密度是H2的43倍,则B的分子式为____________,其中含有3个-CH3的同分异构体的结构简式为___________________________、________________________________;
(3)某气态烃在标准状况下的密度为2.59g/L,该烃的含碳量为82.8%,则分子中碳、氢原子的个数比是______________,分子式是_________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计实验探究SO2和漂粉精反应原理,装置如图所示。、
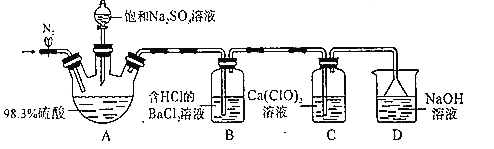
实验操作过程如下:
步骤1:连接装置并检查装置气密性,按如图所示装好药品;
步骤2:打开止水夹,向装置中通入一段时间N2,并关闭止水夹;
步骤3:取下分液漏斗的塞子,旋转活塞,向三颈瓶中滴加饱和Na2SO3溶液。过一会儿,观察到B和C中都产生白色沉淀
步骤4:实验完毕后,检验C中白色固体,白色固体是CaSO4。
回答下列问题:
(1)B装置中盐酸的作用是__;能证明A中产生的“酸雾”含有H2SO4的实验现象是___。
(2)A中硫酸表现出来的性质有__。
(3)步骤2中通入N2的目的是__。
(4)实验完毕后,经检验,D中溶液含有等物质的量浓度的两种还原性盐,写出总反应的离子方程式__。
(5)步骤4检验C中白色沉淀成分的操作是,取少量C中白色固体,滴加足量___(填名称),振荡,白色固体不溶解,则白色固体是CaSO4。
(6)经分析,C中发生化学反应与反应物相对量有关:
若通入少量SO2,则发生反应为3Ca(ClO)2+2SO2+2H2O═2CaSO4↓+4HClO+CaCl2;
若通入过量SO2,则发生反应为Ca(ClO)2+2SO2+2H2O═CaSO4↓+H2SO4+2HCl,SO2+H2OH2SO3。
设计实验证明上述C中通入过量SO2:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是

A. a为电池的正极,发生还原反应
B. b极的电极反应为HCHO+H2O-4e-==CO2+4H+
C. 传感器工作过程中,电解质溶液中硫酸的浓度减小
D. 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物J是一种医药中间体,可通过如下图示路线合成。

已知:![]()
请回答以下问题:
(1)B的结构简式是___________,D的结构简式是___________。
(2)在一定条件下,两个F分子发生分子间脱水生成一种环状酯,该环状酯的结构简式为_______。
(3)A与足量的银氨溶液溶液反应的化学方程式是_________。
(4)J与足量的氢氧化钠溶液反应的化学方程式是__________。
(5)满足以下条件的G的同分异构体(不含G)共有________种;
①含有酯基; ②能与氯化铁溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
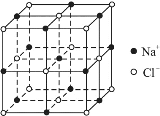
【题目】随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定精确度也越来越高,现有一种简单可行的测定方法,具体步骤为:
(1)将固体NaCl研细、干燥后,准确称取mgNaCl固体并转移到定容仪器A中。
(2)用滴定管向A仪器中滴加苯,不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为Vcm3。
①步骤(1)中A仪器最好用__________(仪器名称)。
②步骤(2)中用酸式滴定管好还是碱式滴定管好,__________,理由是______________。
③能否用胶头滴管代替步骤(2)中的滴定管__________;理由是____________________。
④已知NaCl晶体的结构如上图所示,用X射线测得NaCl晶体中靠得最近的Na+与Cl-间的平均距离为acm,则用上述测定方法测得阿伏加德罗常数NA的表达式为:NA=______mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com