
【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如下图所示。下列说法不正确的是( )
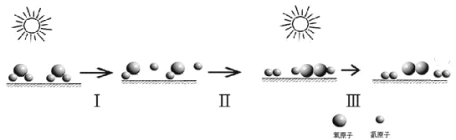
A.整个过程实现了光能向化学能的转换
B.过程Ⅱ有O-O单键生成并放出能量
C.过程Ⅲ发生的化学反应为:2H2O2═2H2O+O2
D.整个过程的总反应方程式为:2H2O→2H2+O2
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。
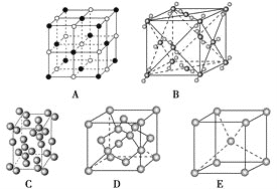
(1)辨别晶胞(请用相应的编号填写)。
①钠晶胞是________;
②碘晶胞是________;
③金刚石晶胞是________;
④干冰晶胞是________;
⑤氯化钠晶胞是________。
(2)与冰的晶体类型相同的是__________。
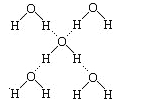
(3)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ·mol-1,除氢键外,水分子间还存在范德华力(11 kJ·mol-1),则冰晶体中氢键的“键能”是________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸乙酯(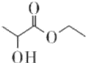 )是一种食用香料,常用于调制果香型、乳酸型食用和酒用精。乳酸乙酯的同分异构体M有如下性质:0.1mol M分别与足量的金属钠和碳酸氢钠反应,产生的气体在相同状况下的体积相同,则M的结构最多有(不考虑空间异构)
)是一种食用香料,常用于调制果香型、乳酸型食用和酒用精。乳酸乙酯的同分异构体M有如下性质:0.1mol M分别与足量的金属钠和碳酸氢钠反应,产生的气体在相同状况下的体积相同,则M的结构最多有(不考虑空间异构)
A. 8种B. 9种C. 10种D. 12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计实验探究SO2和漂粉精反应原理,装置如图所示。、
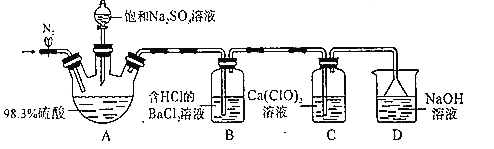
实验操作过程如下:
步骤1:连接装置并检查装置气密性,按如图所示装好药品;
步骤2:打开止水夹,向装置中通入一段时间N2,并关闭止水夹;
步骤3:取下分液漏斗的塞子,旋转活塞,向三颈瓶中滴加饱和Na2SO3溶液。过一会儿,观察到B和C中都产生白色沉淀
步骤4:实验完毕后,检验C中白色固体,白色固体是CaSO4。
回答下列问题:
(1)B装置中盐酸的作用是__;能证明A中产生的“酸雾”含有H2SO4的实验现象是___。
(2)A中硫酸表现出来的性质有__。
(3)步骤2中通入N2的目的是__。
(4)实验完毕后,经检验,D中溶液含有等物质的量浓度的两种还原性盐,写出总反应的离子方程式__。
(5)步骤4检验C中白色沉淀成分的操作是,取少量C中白色固体,滴加足量___(填名称),振荡,白色固体不溶解,则白色固体是CaSO4。
(6)经分析,C中发生化学反应与反应物相对量有关:
若通入少量SO2,则发生反应为3Ca(ClO)2+2SO2+2H2O═2CaSO4↓+4HClO+CaCl2;
若通入过量SO2,则发生反应为Ca(ClO)2+2SO2+2H2O═CaSO4↓+H2SO4+2HCl,SO2+H2OH2SO3。
设计实验证明上述C中通入过量SO2:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是

A. a为电池的正极,发生还原反应
B. b极的电极反应为HCHO+H2O-4e-==CO2+4H+
C. 传感器工作过程中,电解质溶液中硫酸的浓度减小
D. 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2等。利用该固体废渣制取Cu (NO3)2的部分工艺流程如图所示:

(1)Cu与稀硝酸反应的离子方程式为 。
(2)酸溶时,反应温度不宜超过70℃,其主要原因是 ,若保持反应温度为70℃,欲加快反应速率可采取的措施为 (写2种)。
(3)过滤后所得废渣的主要成分的化学式为 。
(4)由Cu(NO3)2溶液制Cu(NO3)2晶体的操作方法是:蒸发浓缩、 、过滤、冰水洗涤、低温烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物J是一种医药中间体,可通过如下图示路线合成。

已知:![]()
请回答以下问题:
(1)B的结构简式是___________,D的结构简式是___________。
(2)在一定条件下,两个F分子发生分子间脱水生成一种环状酯,该环状酯的结构简式为_______。
(3)A与足量的银氨溶液溶液反应的化学方程式是_________。
(4)J与足量的氢氧化钠溶液反应的化学方程式是__________。
(5)满足以下条件的G的同分异构体(不含G)共有________种;
①含有酯基; ②能与氯化铁溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
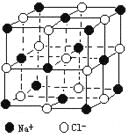
【题目】晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体的晶胞如右图所示。 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m gNaCl固体并转移到定容仪器A中。②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为VmL。回答下列问题:
⑴步骤①中A仪器最好用__________________(填仪器名称)。
⑵能否用胶头滴管代替步骤②中的滴定管______,其原因是____________。
⑶能否用水代替苯_______,其原因是______________________。
⑷经X射线衍射测得NaCl晶胞中最邻近的Na+ 和Cl- 平均距离为acm,则利用上述
方法测得的阿伏加德罗常数的表达式为NA=_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
(1)W2-离子的结构示意图为______________,E元素在周期表中的位置为____________,写出E的最高价氧化物与D的最高价氧化物的水化物反应的离子方程式____________________。
(2)经测定A2W2为二元弱酸,A2W2的电子式为___________,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式__________________________。
(3)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀成.当消耗2mol I﹣时,共转移3mol电子,该反应的离子方程式是_____________________。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,写出该反应方程式______________________,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是_________L(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com