
科目: 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:____。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。
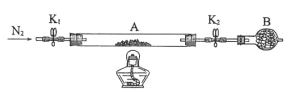
①仪器B的名称是____。
②将下列实验操作步骤正确排序____(填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A
f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=____(列式表示)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
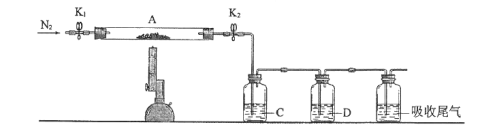
①C、D中的溶液依次为____(填标号)。C、D有气泡,并可观察到的现象分别为____。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式____。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜在生活中有广泛的应用。CuCl2和CuCl是两种常见的盐,广泛应用于工业生产。
I. CuCl2固体遇水易水解。实验室用如图所示的实验仪器及药品来制备纯净、干燥的氯气,并与粗铜(含杂质铁)反应制备氯化铜(铁架台、铁夹及酒精灯省略)。

(1)写出装置A中,发生反应的化学反应方程式:____,装置C的作用是____
(2)完成上述实验,按气流方向连接各仪器接口的顺序是a→___。(每种仪器限使用一次)
(3)上述D装置的作用是____
Ⅱ. CuCl是应用广泛的有机合成催化剂,可采取不同方法制取。CuCl晶体呈白色,露置于潮湿空气中易被氧化。
方法一:向上述制得的氯化铜溶液中通入SO2,加热一段时间即可制得CuCl,写出该反应的离子方程式:___。
方法二:铜粉还原CuSO4溶液
![]()
已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+2Cl-![]() [CuCl3]2-(无色溶液)。
[CuCl3]2-(无色溶液)。
(1)①中,“加热”温度不宜过高和过低,目的是___,当观察到__现象,即表明反应已经完全。
(2)②中,加入大量水的作用是___。(从平衡角度解释)
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型,高效、多功能绿色水处理剂,可通过KClO溶液与Fe(NO3)3溶液的反应制备。已知:①KClO在较高温度下发生歧化反应生成KClO3;
②K2FeO4具有下列性质:可溶于水、微溶于浓KOH溶液;在强碱性溶液中比较稳定;在Fe3+催化作用下发生分解,在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
如图所示是实验室模拟工业制备KClO溶液装置。
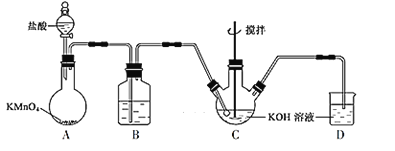
(1)B装置的作用为___。
(2)反应时需将C装置置于冷水浴中,其原因为__。
(3)制备K2FeO4时,不能将碱性的KClO溶液滴加到Fe(NO3)3饱和溶液中,其原因是__,制备K2FeO4的离子方程式:___。
(4)工业上常用废铁屑为原料制备Fe(NO3)3溶液,溶液中可能含有Fe2+,检验Fe2+所需试剂名称___,其反应原理为___(用离子方程式表示)。
(5)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00gK2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,
装有Na2S2O3标准溶液的滴定管起始和终点读数如图所示:
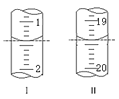
①消耗Na2S2O3标准溶液的体积为___mL。
②原样品中高铁酸钾的质量分数为__。[M(K2FeO4)=198g/mol]
③若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数__(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=﹣1275.6kJ/mol
②H2O(l)═H2O(g)△H=+44.0kJ/mol
写出甲醇燃烧的热化学方程式________.
查看答案和解析>>
科目: 来源: 题型:
【题目】(NH4)2Cr2O7可用作有机合成催化剂、媒染剂、显影液等。某化学兴趣小组对(NH4)2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。请回答下列问题:
(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是___。
(2)为探究(NH4)2Cr2O7(摩尔质量为252g/mol)的分解产物,按如图连接好装置,在A中加入5.040g样品进行实验。
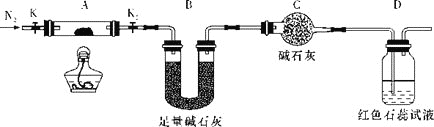
①连接好装置,点燃酒精灯之前,需进行的必要操作是___。
②反应结束后,依然要通一段时间的氮气的原因是___。
③加热A至恒重,观察到D中溶液不变色,同时测得A中残留物为Cr2O3、B中质量的变化为1.44g,写出重铬酸铵加热分解反应的化学方程式:___。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数(杂质不发生反应),其反应原理为2Ba2++Cr2O72-+H2O=2BaCrO4↓+2H+、4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mo1(CH2)6N4H+与1mo1H+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品5.600g,配成500mL溶液,移取25.00mL样品溶液于250mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10mL20.00mol·L-1的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用0.200mo1L-1NaOH标准溶液滴定至终点。重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为20.00mL。
①若滴定终点时,仰视读数,则测定结果___(填“偏大”“偏小”或“无影响”)。
②滴定计算得该样品中N的质量分数为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3 , 则三者由小到大顺序为________
(2)由盖斯定律结合下述反应方程式,回答问题:
①NH3(g)+HCl(g)═NH4Cl(s)△H=﹣176kJ/mol
②NH3(g)+H2O(l)═NH3H2O(aq)△H=﹣35.1kJ/mol
③HCl(g)+H2O(l)═HCl(aq)△H=﹣72.3kJ/mol
④NH3H2O(aq)+HCl(aq)═NH4Cl(aq)△H=﹣52.3kJ/mol
则NH4Cl(s)+2H2O(l)═NH4Cl(aq)其△H等于_________ kJ/mol.
(3)根据下列热化学方程式分析,写出C(s)燃烧热的热化学方程式________
C(s)+H2O(l)═CO(g)+H2(g)△H1=+175.3kJmol﹣1
2CO(g)+O2(g)═2CO2(g)△H2=﹣566.0kJmol﹣1
2H2(g)+O2(g)═2H2O(l)△H3=﹣571.6kJmol﹣1 .
查看答案和解析>>
科目: 来源: 题型:
【题目】己知:Mg(s)+2 H2O (g)=Mg(OH )2(s)+H2(g)△H1=﹣441kJmol﹣1
H2O(g)= ![]() H2(g)+O2(g)△H2=242kJmol﹣1
H2(g)+O2(g)△H2=242kJmol﹣1
Mg(s)+ ![]() O2(g)=MgO(s)△H3=﹣602kJmol﹣1
O2(g)=MgO(s)△H3=﹣602kJmol﹣1
①Mg(OH )2分解的热化学方程式为:________.
②Mg(OH )2可以作为阻燃剂的原因(写一条即可)________.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式正确的是(注:![]() 的绝对值均正确)( )
的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)=2CO2(g) +3H2O(g);△H= —1367.0 kJ/mol(燃烧热)
B.NaOH(aq) + HCl(aq)=NaCl(aq)+ H2O(l);△H= —57.3kJ/mol(中和热)
C.S(s) + O2(g) = SO2(g);△H= —269.8kJ/mol(反应热)
D.2HCl(g)=Cl2(g) + H2(g);△H= — 184.6kJ/mol(反应热)
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E五种中学常见物质均含有同一种元素,且A为单质,有如图2所示的转化关系。则下列分析中不正确的是
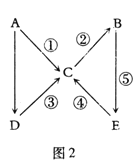
A.若ABCDE中同一种元素的价态均不相同,则A为非金属单质
B.若A为金属钠,则由1mol D完全反应生成C时,一定有1mol电子转移
C.若A为非金属硫,则④的反应类型既可能为氧化还原反应,也可能为非氧化还原反应
D.若A为金属铁,则化合物C和D均可以由化合反应制得
查看答案和解析>>
科目: 来源: 题型:
【题目】某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量的关系如图所示。
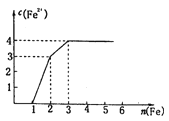
溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
A.1:1:1B.1:3:1C.1:1:4D.3:3:8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com