
����Ŀ��������أ�K2FeO4����һ�����ͣ���Ч�������ɫˮ����������ͨ��KClO��Һ��Fe(NO3)3��Һ�ķ�Ӧ�Ʊ�����֪����KClO�ڽϸ��¶��·����绯��Ӧ����KClO3��
��K2FeO4�����������ʣ�������ˮ������ŨKOH��Һ����ǿ������Һ�бȽ��ȶ�����Fe3���������·����ֽ⣬�������������������£�����ˮ��Ӧ����Fe(OH)3��O2��
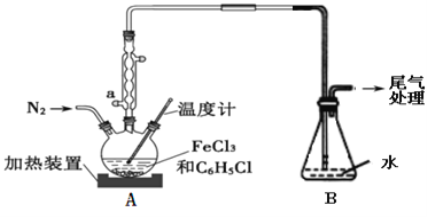
��ͼ��ʾ��ʵ����ģ�ҵ�Ʊ�KClO��Һװ�á�
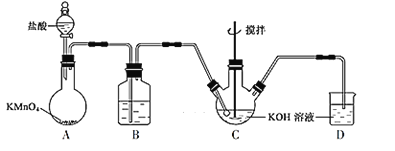
��1��Bװ�õ�����Ϊ___��
��2����Ӧʱ�轫Cװ��������ˮԡ�У���ԭ��Ϊ__��
��3���Ʊ�K2FeO4ʱ�����ܽ����Ե�KClO��Һ�μӵ�Fe(NO3)3������Һ�У���ԭ����__���Ʊ�K2FeO4�����ӷ���ʽ��___��
��4����ҵ�ϳ��÷���мΪԭ���Ʊ�Fe(NO3)3��Һ����Һ�п��ܺ���Fe2+������Fe2+�����Լ�����___���䷴Ӧԭ��Ϊ___�������ӷ���ʽ��ʾ����
��5����ҵ��������ӵ��������ⶨ������صĴ��ȣ��ü���KI��Һ�ܽ�1.00gK2FeO4��Ʒ������pHʹ�������ȫ������ԭ���������ӣ��ٵ���pHΪ3��4����1.0mol/L��Na2S2O3����Һ��Ϊ�ζ������еζ���2Na2S2O3+I2=Na2S4O6+2NaI����������ָʾ����
װ��Na2S2O3����Һ�ĵζ�����ʼ���յ������ͼ��ʾ��
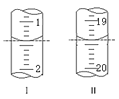
������Na2S2O3����Һ�����Ϊ___mL��
��ԭ��Ʒ�и�����ص���������Ϊ__��[M��K2FeO4��=198g/mol]
����������Na2S2O3����Һ�Ĺ����ж���ʱ���ӿ̶��ߣ��������������ص���������__������ƫ��������ƫ����������Ӱ��������
���𰸡�����HCl KClO�ڽϸ��¶��·����绯��Ӧ����KClO3 ��KClOŨ��Һ�μӵ�Fe(NO3)3������Һ�У�Fe3��������K2FeO4��Fe3���������·����ֽ��KClOŨ��Һ�μӵ�Fe(NO3)3������Һ�У���Һ�����ԣ������������£�K2FeO4����ˮ��Ӧ����Fe(OH)3��O2 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O ���軯�� 3Fe2++2Fe(CN)63-=Fe3[Fe(CN)6]2�� 18.00 89.1% ƫ��
��������
��ʵ��װ��ͼ��֪��Aװ�����ø�����������ᷴӦ�Ƶ��������������лӷ����������Ȼ��⣬����Bװ���б���ʳ��ˮ�dz�ȥ�����е��Ȼ��⣬װ��C��������������������ҺӦ�Ƶô������ƣ���Ӧ��β�������������������ա�
(1)B��Ϊ����ʳ��ˮ���ɳ�ȥ�ӷ���HCl��
(2)Cװ��������ˮԡ�У���ֹ����KClO3��
(3)����Ϣ�ڿ�֪K2FeO4��Fe3+�������·����ֽ⣬��KOH��Һ�У�Fe(NO3)3��KClO��Ӧ����K2FeO4��KCl��KNO3��
(4)�������������軯�ط�Ӧ������ɫ������
(5����ͼ��֪����ʼ���յ�����ֱ�Ϊ1.40mL��19.40mL��
���ɵ��ӵ�ʧ�غ��֪FeO42-��2I2�����2Na2S2O3+I2�TNa2S4O6+2NaI���ù�ϵʽFeO42-��2I2��4Na2S2O3���Դ˼��㣻
������Na2S2O3����Һ�Ĺ����ж���ʱ���ӿ̶��ߣ����ƫС����Һ��Ũ��ƫ�ζ�ʱ���ı�Һ�����ƫС��
(1)Bװ�õ�����Ϊ����HCl��
(2)��Ӧʱ�轫Cװ��������ˮԡ�У���ԭ��ΪKClO�ڽϸ��¶��·����绯��Ӧ����KClO3��
(3)�Ʊ�K2FeO4ʱ�����ܽ����Ե�KClO��Һ�μӵ�Fe(NO3)3������Һ�У���ԭ���ǽ�KClOŨ��Һ�μӵ�Fe(NO3)3������Һ�У�Fe3+������K2FeO4��Fe3+�������·����ֽ�(��KClOŨ��Һ�μӵ�Fe(NO3)3������Һ�У���Һ�����ԣ������������£�K2FeO4����ˮ��Ӧ����Fe(OH)3��O2����KOH��Һ�У�Fe(NO3)3��KClOӦ����K2FeO4��KCl��KNO3����Ӧ�ķ���ʽΪ2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O�����ӷ���ʽΪ2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O��
(4)����Fe2+�����Լ�����Ϊ���軯�أ��䷴Ӧԭ��Ϊ3Fe2++2Fe(CN)63-=Fe3[Fe(CN)6]2����
(5)����ͼ��֪����ʼ���յ�����ֱ�Ϊ1.40mL��19.40mL��������Na2S2O3����Һ�����Ϊ18.00mL��
���ɵ��ӵ�ʧ�غ��֪FeO42-��2I2�����2Na2S2O3+I2�TNa2S4O6+2NaI��FeO422I24Na2S2O3����֪ԭ��Ʒ�и�����ص���������Ϊ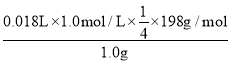 ��100%=89.1%��
��100%=89.1%��
������Na2S2O3����Һ�Ĺ����ж���ʱ���ӿ̶��ߣ����ƫС����Һ��Ũ��ƫ�ζ�ʱ���ı�Һ�����ƫС���������������ص���������ƫ�͡�


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCl2��һ�ֳ��õĻ�ԭ����ýȾ����ij��ѧʵ��С����ʵ���������������ַ������Ʊ���ˮFeCl2���й����ʵ��������£�
| C6H5Cl(�ȱ��� | C6H4Cl2(���ȱ��� | FeCl3 | FeCl2 |
�ܽ��� | ������ˮ�������ڱ����Ҵ� | ������C6H5Cl��C6H4Cl2������ �������Ҵ�������ˮ | ||
�۵�/�� | -45 | 53 | ������ | |
�е�/�� | 132 | 173 | ||
(1)��H2��ԭ��ˮFeCl3��ȡFeCl2���й�װ�����£�
��H2��ԭ��ˮFeCl3��ȡFeCl2�Ļ�ѧ����ʽΪ_____________��
�ڰ����������ҵķ�����������������˳��Ϊ_________������ĸ��װ�ÿɶ��ʹ�ã���C��ʢ�ŵ��Լ���_____________��
�۸��Ʊ�װ�õ�ȱ��Ϊ________________��
(2)���÷�Ӧ2FeCl3+C6H5Cl��2FeCl2+C6H4Cl2+HCl������ȡ��ˮFeCl2���ⶨFeCl3��ת���ʡ�����ͼװ�ã���������ƿ�з���32.5g��ˮ�Ȼ����������ȱ������Ʒ�Ӧ�¶���һ����Χ����3h����ȴ�������ᴿ�õ��ֲ�Ʒ��
������a��������__________��
�ڷ�Ӧ��������ȴʵ��װ��A����������ƿ�����ʵ����������ˡ�ϴ�ӡ�����õ��ֲ�Ʒ��ϴ�����õ��Լ�������____��������Һ��C6H5C1�IJ���������______��
�۷�Ӧ����ƿ����Һ���250mL����ȡ25.00mL������Һ����0.40mol/LNaOH��Һ�ζ����յ�ʱ����NaOH��ҺΪ19.60 mL�����Ȼ�����ת����Ϊ__________��
��Ϊ�˼���ʵ��������ȡ��ˮFeCl2������Ӧ��ȡ�Ĵ�ʩ�У�________��д��һ�㼴�ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
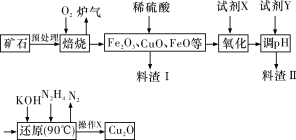
����Ŀ��������ͭ(Cu2O)��һ����;�㷺�Ĺ����ϣ�ij��������ͭ��ʯ(��CuFeS2��Cu2S��)Ϊԭ����ȡCu2O�Ĺ����������£�
�����¼������ʿ�ʼ�γɳ�������ȫ����ʱ��pH���±���
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
��ʼ���� | 7.5 | 2.7 | 4.8 |
��ȫ���� | 9.0 | 3.7 | 6.4 |
(1)¯���е��к�����ɷ���__________(�ѧʽ)��Cu2S��O2��Ӧʱ���������뻹ԭ�������ʵ���֮��Ϊ__________��
(2)���Լ�X��H2O2��Һ������������Ӧ�����ӷ���ʽΪ____________________����д��H2O2�ĵ���ʽ��__________�����Լ�X��__________ʱ���������ڽ��������ɱ���
(3)�����Լ�Y��pHʱ��pH�ĵ��ط�Χ��__________��
(4)����X����__________��ϴ�ӡ���ɣ����к��ʱҪ������������Ŀ����_________��
(5)��ͭ��ʯī���缫�����Ũ��ǿ������Һ���Ƶ�����Cu2O��д������������Cu2O�ĵ缫��Ӧʽ��____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��������֪���ʵ���Ũ�ȵ��������ⶨδ֪���ʵ���Ũ�ȵ�����������Һ�����ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ��ʾ��
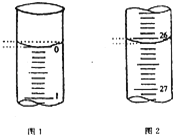
(1)����������Һ�����Ϊ________mL
(2)�ñ���������Һ�ζ����������������Һʱ���÷�̪��ָʾ�����ﵽ�ζ��յ�������ǣ�_____
(3)ijѧ����������ʵ��ֱ��¼�й��������±���
�ζ����� | ��������������Һ�����/mL | 0.1000molL-1��������/mL | ||
�ζ�ǰ�̶� | �ζ���̶� | ��Һ���/mL | ||
��һ�� | 25.00 | 0.00 | 26.11 | 26.11 |
�ڶ��� | 25.00 | 1.56 | 30.30 | 28.74 |
������ | 25.00 | 0.22 | 26.31 | 26.09 |
��ѡ�����к��������г�������������Һ���ʵ���Ũ��(����������4λ��Ч����)��c(NaOH)��_______
(4)���ڴ��������ʹ��������������������Һ��Ũ��ƫ�ߵ���_______(��д���)��
A���к͵ζ����յ�ʱ���ӵζ�����Һ�������
B����ʽ�ζ���������ˮϴ��������ȡ��25.00mL�������Һע����ƿ���еζ���
C����ʽ�ζ���������ˮϴ��������װ����Һ���ζ���
D������õı���Һ�����������ˮϴ�����Լ�ƿ��Ȼ�������ζ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ��ȷ���ǣ�ע��![]() �ľ���ֵ����ȷ��( )
�ľ���ֵ����ȷ��( )
A.C2H5OH(l)+3O2(g)=2CO2(g) +3H2O(g)����H= ��1367.0 kJ/mol��ȼ���ȣ�
B.NaOH(aq) + HCl(aq)=NaCl(aq)+ H2O(l)����H= ��57.3kJ/mol���к��ȣ�
C.S(s) + O2(g) = SO2(g)����H= ��269.8kJ/mol����Ӧ�ȣ�
D.2HCl(g)=Cl2(g) + H2(g)����H= �� 184.6kJ/mol����Ӧ�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶������巴Ӧ�ﵽ��ѧƽ�⣬ƽ�ⳣ��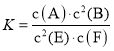 ������ʱ�����¶��ʵ����ͣ�F��Ũ�����ӡ�����˵����ȷ����
������ʱ�����¶��ʵ����ͣ�F��Ũ�����ӡ�����˵����ȷ����
A.����ʱ���������г���ϡ�����壬��Ӧ���ʲ���
B.����c(A)��c(B)��K����
C.�÷�Ӧ�Ļ�ѧ����ʽΪ2E(g)+F(s)A(g)+2B(g)
D.����ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ս��������ᡶ�����������桷�״�д�����ƶ���硢�������ʩ�Ľ���������ͼ��һ�������缫��Ӧ���漰������������ȫ������������Ч�ʿɴ�80%������˵���д������

A. ��װ�ý���ѧ��ת��Ϊ����
B. ���ӽ���Ĥ����H+��OH��ͨ��
C. ����ΪA����缫��Ӧʽ��H2��2e�� + 2OH�� = 2H2O
D. ��ص��ܷ�ӦΪH+ + OH��![]() H2O
H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣�����ÿ��������Ŵ���һ�ֶ�����Ԫ�ء�
| IA | 0 | |||||||
1 | �� | II A | III A | IV A | V A | VI A | VIIA | ||
2 | �� | �� | |||||||
3 | �� | �� | �� | ||||||
�밴Ҫ��ش��������⣺
��1��Ԫ����������������Ӧ��ˮ����Ļ�ѧʽΪ ��
��2����������Ԫ�ص�ԭ�Ӱ뾶�ϴ����______________����Ԫ�ط��ţ���
��3������������Ԫ�صĽ����Խ�ǿ���� ����Ԫ�ط��ţ���
��4��Ԫ������Ԫ�������⻯�����������ˮ���������������ֱ�պȡ���ǵ�Ũ��Һ����ӽ�ʱ���ɿ��������İ��̣�д������������Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ֤��������������ʣ����з�������ȷ���ǣ� ��
A.�Ƚ���ͬ���ʵ���Ũ�ȵ�NaOH��Һ�ʹ�����Һǡ�÷�Ӧ��ȫʱ��������Һ�����
B.��1mLpH=3�Ĵ�����Һϡ�͵�100mL������pHС��5
C.�Ƚ�Ũ�Ⱦ�Ϊ0.1mol��L-1����ʹ�����Һ�ĵ�������
D.�ⶨ0.1mol��L-1������Һ��PH
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com