
科目: 来源: 题型:
【题目】25 ℃时,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
下列说法中正确的是( )
A. ①稀释到原来的100倍后,pH与②相同
B. 等体积①③混合、等体积②④混合所得的溶液都呈酸性
C. ①②中分别加入少量CH3COONa固体,![]() 的值都变小
的值都变小
D. ③④稀释到原来的100倍后,稀释后④溶液中的pH大
查看答案和解析>>
科目: 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是
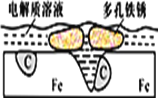
A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. C是正极,O2在C表面上发生还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】往锅炉注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,再用盐酸去除,下列叙述正确的是
A. 温度升高Na2CO3溶液的Kw和c(H+)均会增大
B. CaSO4能转化为CaCO3,说明Ksp(CaCO3)>Ksp(CaSO4)
C. CaCO3溶解于盐酸而CaSO4不溶,是因为硫酸酸性强于盐酸
D. 沉淀转化的离子方程式为CO32(aq)+CaSO4(s)![]() CaCO3(s)+SO42(aq)
CaCO3(s)+SO42(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目: 来源: 题型:
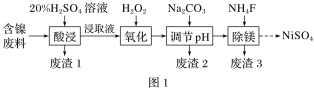
【题目】某含镍(NiO)废料中有FeO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4的工艺流程如图1所示:
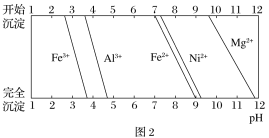
已知:①有关金属离子生成氢氧化物沉淀所需的pH如图2所示。
②25 ℃时,NH3·H2O的电离常数Kb=1.8×10-5。HF的电离常数Ka=7.2×10-4,Ksp(MgF2)=7.4×10-11。
(1)“酸浸”时,为提高浸出速率,可采取的措施有______________(写一条即可)。
(2)废渣1的主要成分是________(填化学式)。“氧化”步骤中加入H2O2的目的是____________(用离子方程式表示)。加Na2CO3调节溶液的pH至5,得到废渣2的主要成分是____________(填化学式)。
(3)25 ℃时,1 mol·L-1的NaF溶液中c(OH-)=____________(列出计算式即可) mol·L-1。NH4F溶液呈________(填“酸性”“碱性”或“中性”)。
(4)已知沉淀前溶液中c(Mg2+)=1.85×10-3mol·L-1,当除镁率达到99%时,溶液中c(F-)=________ mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z是同周期主族元素,Y的最外层电子数是X次外层电子数的3倍,四种元素与锂组成的盐是一种新型的锂离子电池的电解质(结构如图,箭头指向表示共同电子对由W提供)。下列说法不正确的是( )
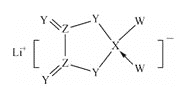
A.W的非金属性比Y的强 B.在该物质中Ⅹ原子满足8电子稳定结构
C.该物质中含离子键和共价键 D.Z的氧化物都易溶于水中
查看答案和解析>>
科目: 来源: 题型:
【题目】下表中的实线表示元素周期表的部分边界。
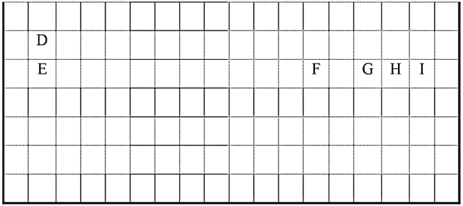
(1)请在上表中用实线补出元素周期表的上边界。_____________
(2)某主族元素原子的核外电子排布为: ,该元素在元素周期表中的位置为_______________。
,该元素在元素周期表中的位置为_______________。
(3)元素I的非金属性________(填“强于”或“弱于”)元素H,用原子结构的观点解释原因:同周期元素随着原子序数的递增,______________________,非金属性增强。设计实验证明元素E的金属性强于元素F:__________________________。
(4)处于周期表中对角线位置(左上方和右下方) 的元素,其性质具有相似性,称为“对角线规则”。元素D与F的单质及其化合物性质相似,如D、DO、D(OH)2与NaOH溶液都能反应生成Na2DO2等物质。回答下列问题。
①写出F的单质与氢氧化钠溶液反应的离子方程式___________________________。
②鉴别元素D与E的氢氧化物可用试剂是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是用一种新型锂电池电解处理含NH4+的工业废水的装置图。处理过程中,NH4+转化为可参与大气循环的气体。下列说法正确的是( )

A.废水处理过程中,Y电极上发生氧化反应
B.废水处理过程中,X电极附近溶液酸性减弱
C.废水处理过程中,W电极反应式为O2+4e-+4H+=2H2O
D.若消耗7gLi则质子交换膜左侧电解质溶液减少![]() g
g
查看答案和解析>>
科目: 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
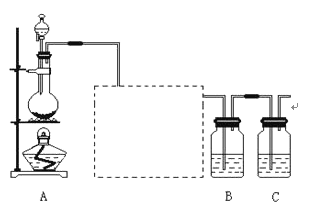
(1)装置A的分液漏斗中盛装的试剂是____,烧瓶中的化学反应方程式___。
(2)画出虚线框内的实验装置图______,所加试剂为______,装置的作用______。
(3)装置B中盛放的试剂是______ (选填下列所给试剂的代码),实验现象为______,该反应的离子方程式是______,该反应属于四种基本反应类型中的______反应。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2﹣比Cl﹣易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁;⑦硫原子与氯原子电子层数相同,氯原子半径小于硫原子.可说明氯比硫非金属性强的是______。
A.全部 B.②③④⑥⑦C.①②④⑤⑥D. 除 ①以外
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,写出反应的离子方程式______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com