
科目: 来源: 题型:
【题目】下图表示常温下稀释醋酸和次氯酸两种酸的稀溶液时,溶液pH随加水量的变化而变化的曲线。(已知:25℃时,CH3COOH的电离平衡常数Ka=1.8×10-5;HClO的电离平衡常数Ka=3.0×10-8。)下列说法正确的是 ( )
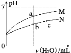
A.曲线M代表HClO溶液加水稀释情况
B.a点酸溶液中水电离的c(H+)小于b点酸溶液中水电离的c(H+)
C.b、c两点处的溶液中c(R-)/[c(HR)·c(OH-)]相等(HR代表CH3COOH或HClO)
D.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目: 来源: 题型:
【题目】现有0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )
①电离程度增大 ②c(NH3·H2O)增大 ③NH![]() 数目增多 ④c(OH-)增大 ⑤导电性增强⑥
数目增多 ④c(OH-)增大 ⑤导电性增强⑥![]() 增大
增大
A. ①②③ B. ①③⑤ C. ①③⑥ D. ②④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】利用有机物苯实现电化学储氢的原理如下图所示。下列说法中不正确的是( )
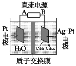
A.Ag-Pt极的电极反应式为:C6H6+6H++6e-== C6H12
B.总反应式为2C6H6+6H2O→2C6H12+3O2↑
C.通电后H+离子由左池向右池迁移
D.当电路中通过1mol电子的电量时,会有0.25molO2生成
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是

A. 加入Na2SO4可使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A.标准状况下,1mol -OH中含有7NA个电子
B.在精炼铜的过程中,当阳极有32g铜参加反应时转移电子数为NA
C.常温常压下50g 46%的乙醇溶液中,所含氧原子数目为2NA
D.2mol·L-1碳酸氢钠溶液中Na+的数目为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的绿色消毒剂,纯ClO2易分解爆炸,其一种生产工艺如下,回答下列问题:
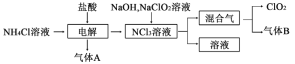
(1)气体A的名称为___________________,NCl3的电子式为_________。
(2)“电解”过程中生成的氧化产物与还原产物的物质的量之比为________。
(3)气体B能使石蕊试液显蓝色,写出NaClO2溶液和NCl3溶液在碱性条件下生成“混合气”的化学方程式____________。
(4)通常用单位质量的消毒剂得到电子的多少来衡量消毒效率的大小。C1O2和C12在消毒时自身均被还原为Cl-,则C1O2的消毒效率是Cl2的__________倍。
(5)科学家又研究出了一种新的制备C1O2的方法,反应原理如下:H2C2O4+2NaClO3+H2SO4=Na2SO4+2CO2↑+2ClO2↑+2H2O。此法提高了生产及储存、运输的安全性,原因是_____________________。若反应中转移1mol电子,则生成C1O2 ______ g。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物I是临床常用的镇静、麻醉药物,其合成路线如下:
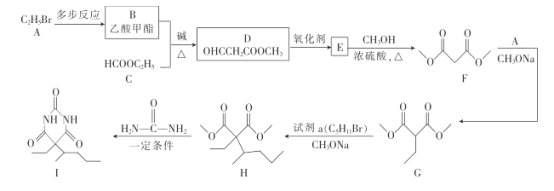
已知:R'、R〞代表烃基或氢原子
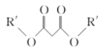 + R〞Br+CH3ONa
+ R〞Br+CH3ONa![]()
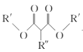 +CH3OH+NaBr
+CH3OH+NaBr
回答下列问题:.
(1)A的名称为________,D中官能团的名称为____。
(2)试剂a的结构简式为_______,I 的分子式为______。
(3)写出E→F 的化学方程式: _________。反应G→H的反应类型是_________。
(4)满足下列要求的G的同分异构体共有.___种,其中核磁共振氢谱图中峰面积比为9 : 2: 1的有机物的结构简式为. _________。
a 只有一种官能团 b 能与NaHCO3溶液反应放出气体 c 结构中有3个甲基
(5)以CH2 BrCH2CH2 Br、CH3OH、CH3ONa为原料,无机试剂任选,制备![]() 的流程如下,请将有关内容补充完整: ____,____,____,____。
的流程如下,请将有关内容补充完整: ____,____,____,____。
CH2BrCH2CH2Br![]()
![]()
![]() HOOCCH2COOH
HOOCCH2COOH![]() CH3OOCCH2COOCH3
CH3OOCCH2COOCH3
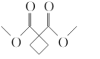
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化钒(VO2)是一种新型热敏材料。实验室以V2O5为原料合成用于制备VO2的氧钒( IV )碱式碳酸铵晶体,过程如下:
V2O5![]() VOCl2溶液
VOCl2溶液![]() (NH4)5[(VO)6(CO3)4(OH)9]10·H2O
(NH4)5[(VO)6(CO3)4(OH)9]10·H2O
回答下列问题:
(1)步骤i中生成VOCl2的同时生成一种无色无污染的气体,该反应的化学方程式为____。也可只用浓盐酸与V2O5来制备VOCl2溶液,从环境角度考虑,该方法的缺点是_______。
(2)步骤ii可在如图装置(气密性良好)中进行。已知:VO2+能被O2氧化。

①药品填装完成后的实验操作是____(填活塞“a”“b”的操作)。
②若无装置B,则导致的后果是____。
(3)加完VOCl2后继续搅拌数分钟,使反应完全,小心取下分液漏斗,停止通气,立即塞上橡胶塞,将锥形瓶置于CO2保护下的干燥器中,静置过夜,得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,除去水分,再用乙醚洗涤2次,抽干称重。用饱和NH4 HCO3溶液洗涤除去的阴离子主要是____。
(4)测定氧钒( IV )碱式碳酸铵晶体粗产品中钒的含量。
称量4.246g样品于锥形瓶中,用20mL蒸馏水与30mL硫酸混合溶解后,加0.02 mol·L-1的KMnO4溶液至稍过量,充分反应后继续加1% NaNO2溶液至稍过量,再用尿素除去过量的NaNO2 ,最后用0.08 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为30.00 mL。(滴定反应:VO2+ + Fe2++2H+=VO2++ Fe3++H2O)
①NaNO2溶液的作用是____。
②粗产品中钒的质量分数为____(精确到小数点后两位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】尿素[CO(NH2)2]是可由无机化合物合成的有机化合物,通常用作植物的氮肥。
(1)合成尿素的主要反应如下:
i.2NH3(g)+CO2(g)![]()
![]() (l)(氨基甲酸铵)△H=-159.5kJ·mol-1
(l)(氨基甲酸铵)△H=-159.5kJ·mol-1
ii. ![]() (l)
(l)![]()
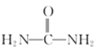 (l)+H2O(g)△H=+116.5kJ·mol-1
(l)+H2O(g)△H=+116.5kJ·mol-1
①CO2和NH3合成尿素的热化学方程式是____。
②工业上提高氨碳比[![]() (原料用量均增大),可以提高尿素的产率,结合反应i~ii,解释尿素产率提高的原因: ____。
(原料用量均增大),可以提高尿素的产率,结合反应i~ii,解释尿素产率提高的原因: ____。
(2)某科研小组模拟工业合成尿素,一定条件下,在0.5 L的密闭容器中充入4 mol NH3和1molCO2,测得反应中各组分的物质的量随时间变化如图所示。.
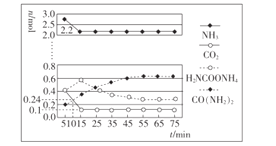
①反应进行到10 min时,用CO2表示反应i的速率v(CO2)=___。
②已知总反应的快慢由慢的一步反应决定,则合成尿素总反应进行到___min时达到平衡。
③合成尿素总反应的平衡常数为____。
(3)我国研制出金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图)。
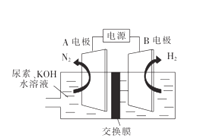
①电极B为___(填“阴”或“阳”)极。
②A电极的电极反应式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com