
【题目】化合物I是临床常用的镇静、麻醉药物,其合成路线如下:
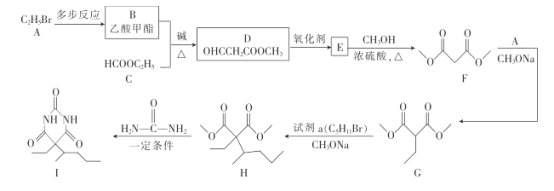
已知:R'、R〞代表烃基或氢原子
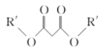 + R〞Br+CH3ONa
+ R〞Br+CH3ONa![]()
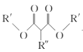 +CH3OH+NaBr
+CH3OH+NaBr
回答下列问题:.
(1)A的名称为________,D中官能团的名称为____。
(2)试剂a的结构简式为_______,I 的分子式为______。
(3)写出E→F 的化学方程式: _________。反应G→H的反应类型是_________。
(4)满足下列要求的G的同分异构体共有.___种,其中核磁共振氢谱图中峰面积比为9 : 2: 1的有机物的结构简式为. _________。
a 只有一种官能团 b 能与NaHCO3溶液反应放出气体 c 结构中有3个甲基
(5)以CH2 BrCH2CH2 Br、CH3OH、CH3ONa为原料,无机试剂任选,制备![]() 的流程如下,请将有关内容补充完整: ____,____,____,____。
的流程如下,请将有关内容补充完整: ____,____,____,____。
CH2BrCH2CH2Br![]()
![]()
![]() HOOCCH2COOH
HOOCCH2COOH![]() CH3OOCCH2COOCH3
CH3OOCCH2COOCH3
【答案】溴乙烷 醛基、酯基  C11H18N2O3
C11H18N2O3  +CH3OH
+CH3OH![]()
 +H2O 取代反应 3 HOOCCH(CH3)C(CH3)2COOH、
+H2O 取代反应 3 HOOCCH(CH3)C(CH3)2COOH、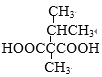 、CH(COOH)2C(CH3)3
、CH(COOH)2C(CH3)3 ![]() HOCH2CH2CH2OH
HOCH2CH2CH2OH ![]() CH2BrCH2CH2Br
CH2BrCH2CH2Br
【解析】
根据合成路线图及题给反应信息知,B(乙酸乙酯)与C发生取代反应生成D  ,E与甲醇发生酯化反应生成F
,E与甲醇发生酯化反应生成F 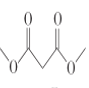 ,则E为
,则E为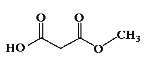 ,F与溴乙烷发生题给反应生成G,对比G和F的结构,结合信息反应知试剂a为
,F与溴乙烷发生题给反应生成G,对比G和F的结构,结合信息反应知试剂a为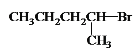 ,结合H和I的结构变化分析,可知H和NH2CONH2脱去2分子CH3OH形成六元环,据此分析解答。
,结合H和I的结构变化分析,可知H和NH2CONH2脱去2分子CH3OH形成六元环,据此分析解答。
(1)根据A的结构简式分析,A为溴乙烷;D为 ,所含官能团有醛基、酯基,故答案为:溴乙烷;醛基、酯基;
,所含官能团有醛基、酯基,故答案为:溴乙烷;醛基、酯基;
(2)根据G和H的结构变化,结合题给反应信息知,试剂a的结构简式为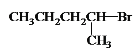 ;根据I 的结构简式分析其分子式为C11H18N2O3,故答案为:
;根据I 的结构简式分析其分子式为C11H18N2O3,故答案为: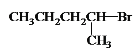 ;C11H18N2O3;
;C11H18N2O3;
(3)E与甲醇发生酯化反应得到F,化学方程式为: +CH3OH
+CH3OH![]()
 +H2O;比较G和H的结构变化,反应G→H的反应类型是取代反应,故答案为:
+H2O;比较G和H的结构变化,反应G→H的反应类型是取代反应,故答案为: +CH3OH
+CH3OH![]()
 +H2O;取代反应;
+H2O;取代反应;
(4)G为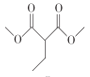 ,同分异构体中只有一种官能团,能与NaHCO3溶液反应放出气体,则含有2个羧基,结构中有3个甲基的结构有
,同分异构体中只有一种官能团,能与NaHCO3溶液反应放出气体,则含有2个羧基,结构中有3个甲基的结构有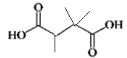 、
、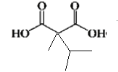 、CH(COOH)2C(CH3)3共3种,核磁共振氢谱图中峰面积比为9 : 2: 1,则有3种不同化学环境的H,且原子个数比为9 : 2: 1,其结构为:
、CH(COOH)2C(CH3)3共3种,核磁共振氢谱图中峰面积比为9 : 2: 1,则有3种不同化学环境的H,且原子个数比为9 : 2: 1,其结构为: 、
、 ,CH(COOH)2C(CH3)3,故答案为:3;HOOCCH(CH3)C(CH3)2COOH、
,CH(COOH)2C(CH3)3,故答案为:3;HOOCCH(CH3)C(CH3)2COOH、 、CH(COOH)2C(CH3)3;
、CH(COOH)2C(CH3)3;
(5)可利用CH2 BrCH2CH2 Br先水解再氧化得到HOOCCH2COOH,HOOCCH2COOH再与甲醇酯化即可生成CH3OOCCH2COOCH3,最后CH3OOCCH2COOCH3、CH2BrCH2CH2 Br、CH3ONa发生信息中的反应成环得到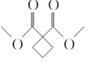 ,CH2BrCH2CH2Br在氢氧化钠溶液中加热水解生成HOCH2CH2CH2OH,HOCH2CH2CH2OH被酸性高锰酸钾溶液氧化生成HOOCCH2COOH,故答案为:
,CH2BrCH2CH2Br在氢氧化钠溶液中加热水解生成HOCH2CH2CH2OH,HOCH2CH2CH2OH被酸性高锰酸钾溶液氧化生成HOOCCH2COOH,故答案为:![]() ;HOCH2CH2CH2OH;
;HOCH2CH2CH2OH;![]() ;CH2BrCH2CH2Br。
;CH2BrCH2CH2Br。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下图所示:

关于咖啡鞣酸的下列叙述正确的是( )
A.分子式为C16H13O9
B.1 mol咖啡鞣酸可与含8 mol NaOH的溶液反应
C.能使酸性KMnO4溶液褪色,说明分子结构中含有碳碳双键
D.与浓溴水能发生两种类型的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4 L乙酸中含有的碳碳单键总数为2NA
B.常温下,46 g NO2气体中所含有的分子数为NA
C.1 mol氖气中含有的原子总数为NA
D.0.1 L0.1 mol· L-1 MgCl2溶液中的Mg2+数目为0. 01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
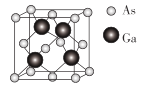
【题目】Ga、N、Ni、As等元素常用于制造高科技材料。回答下列问题:
(1)基态As原子核外电子排布式为[ Ar] _____。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左向右依次增大的原因是___________;氮元素的E1呈现异常的原因是________。

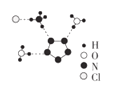
(3)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R表示)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。图中虚线代表氢键,其表示式为(NH4+ )N— H…Cl、_______、_________。
(4)8-羟基喹啉铝(分子式为C27 H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH与8-羟基喹啉(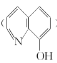 )合成。LiAlH中阴离子的空间构型为___ ;8- 羟基喹啉所含元素中电负性最大的是___(填元素符号),N、O的杂化方式依次为___、____。
)合成。LiAlH中阴离子的空间构型为___ ;8- 羟基喹啉所含元素中电负性最大的是___(填元素符号),N、O的杂化方式依次为___、____。
(5)GaAs的晶胞结构如图所示,其晶胞参数为a pm。设阿伏加德罗常数的值为NA,则GaAs的密度是_______g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )
①电离程度增大 ②c(NH3·H2O)增大 ③NH![]() 数目增多 ④c(OH-)增大 ⑤导电性增强⑥
数目增多 ④c(OH-)增大 ⑤导电性增强⑥![]() 增大
增大
A. ①②③ B. ①③⑤ C. ①③⑥ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下表数据:
化学式 | 电离平衡常数(25℃) |
HCN | K=5.0×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7 ,K2=4.7×10-11 |
① 25℃时,等浓度的四种溶液:a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液,pH由大到小的顺序为_______(填序号)。
② 将0.2mol/LHCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液显碱性,则c(HCN)、c(H+)、c(OH-)、c(CN-)、c(Na+)浓度排序为_______,c(HCN)+c(CN-)_____(填“>”、“<”或“=”)0.1mol/L。
③ 相同条件下,取等体积等pH的a.HCN溶液 b. CH3COOH溶液 c.H2CO3溶液,各稀释100 倍,稀释后的溶液,其pH大小关系为_______(填序号)。
④ 25℃时,将体积为Va,pH = 13的某一元强碱与体积为Vb,pH=2的某二元强酸混合,若所得溶液的pH=11,则Va:Vb=________。
(2)温度为T℃时水的离子积常数为Kw,该温度下,将浓度为amol/L的H2SO4与bmol/L的一元碱AOH等体积混合。则可判断溶液呈中性的是_______(填序号)。
①混合溶液的pH=7 ②c(SO42-)=![]() c(A+)
c(A+)
③混合溶液中c(H+)c(OH-)=Kw ④ 混合溶液中c(OH-)=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是生产生活中的常见有机物的分子式、结构式、结构简式或名称有关说法正确的是
①![]() ②
②![]() ③
③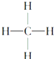 ④
④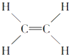 ⑤CH3CH2OH
⑤CH3CH2OH
⑥C6H12O6⑦CH3COOH ⑧硬脂酸甘油酯 ⑨蛋白质 ⑩聚乙烯
A. 能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩
B. 投入钠能产生H2的是⑤⑦⑧⑨
C. 属于高分子材料的是⑧⑨⑩
D. 含碳量最高、有毒、常温下为液体且点燃时有浓烟的是①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类化合物与格氏试剂(![]() ,
,![]() 、Br、I)的反应是合成叔醇类化合物的重要方法,可用于制备含氧多官能团化合物。化合物F的合成路线如下,回答下列问题:
、Br、I)的反应是合成叔醇类化合物的重要方法,可用于制备含氧多官能团化合物。化合物F的合成路线如下,回答下列问题:
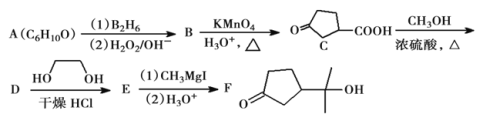
已知:①![]()
②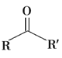
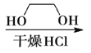
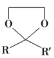
![]()
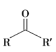
③![]()
![]()
![]()
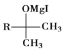
![]()
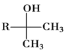
(1)A的结构简式为________;B中官能团的名称为________;![]() 的反应程式为________,其反应类型为________。
的反应程式为________,其反应类型为________。
(2)C与足量的![]() 反应后得到物质G,写出符合下列条件的G的同分异构体________(填结构简式,不考虑立体异构)。
反应后得到物质G,写出符合下列条件的G的同分异构体________(填结构简式,不考虑立体异构)。
①含有五元环结构;②能与![]() 溶液反应放出
溶液反应放出![]() 气体;
气体;
③![]() 与足量的钠反应,产生
与足量的钠反应,产生![]() 。
。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。用“*”标出化合物F中的手性碳原子。__________
(4)写出以![]() 、格氏试剂和
、格氏试剂和![]() 为原料制备的合成
为原料制备的合成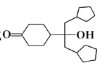 路线(其他试剂任选)。__________
路线(其他试剂任选)。__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com