
科目: 来源: 题型:
【题目】已知溶解度也可用物质的量浓度表示,25℃时,Ag2CrO4在不同浓度CrO42-溶液中的溶解度如图所示。又知Ksp(AgCl)=1.8×10-10。下列说法正确的是
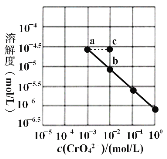
A.图中a、b两点c(Ag+)相同
B.该温度下,Ag2CrO4溶度积的数量级为10-12
C.加热蒸发饱和Ag2CrO4溶液再恢复到25℃,可使溶液由a点变到b点
D.将0.01 mol/L AgNO3溶液滴入20mL0.01 mol/L KCl和0.01 mol/L K2CrO4的混合溶液中,CrO42-先沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】某化合物的结构如图所示,分子中所有原子都达到了 8电子稳定结构,X、Y、Z、W是原子序数依次增大的短周期主族元素,原子半径:r(X)>r(Y)>r(Z),W的单质可用来制取漂白剂和自来水消毒。下列说法正确的是
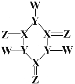
A.YZ2属于酸性氧化物
B.X的氧化物的水化物酸性弱于W的氧化物的水化物酸性
C.X、Y、Z与氢元素均可形成含非极性键的二元化合物
D.Z分别与W、X、Y形成的二元化合物均不止一种
查看答案和解析>>
科目: 来源: 题型:
【题目】当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。其中,甲池为3 mol/L的AgNO3溶液,乙池为1 mol/L的AgNO3溶液A、B均为Ag电极。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法不正确的是
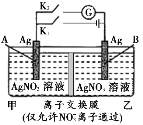
A.断开K1、闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等
B.断开K1、闭合K2,当转移0.1 mol e-时,乙池溶液质量增加17.0 g
C.当电流计指针归零后,断开K2、闭合K1,一段时间后B电极的质量增加
D.当电流计指针归零后,断开K2、闭合K1,乙池溶液浓度增大
查看答案和解析>>
科目: 来源: 题型:
【题目】由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置或操作 | 取两支试管各加入4 mL 0.01 mol/L的草酸溶液,分别滴加2 mL 0.1 mol/L、0.2 mol/L的高锰酸钾溶液 |
|
| 向分别盛有5 mL 0.1 mol/L的硫代硫酸钠溶液的试管中滴加5 mL 0.1 mo/L的硫酸溶液,一段时间后,分别放在冷水和热水中。 |
现象 | 褪色并观察褪色的时间 | 左边棉球变黄,右边棉球变蓝 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊且热水中首先出现浑浊 |
结论 | 其他条件不变时,反应物浓度越大,反应速率越快 | 氧化性:Cl2>Br2>I2 | 溶解度:AgCl>AgBr>AgI | 不能说明温度越高,速率越快 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知每个手性碳原子具有一对旋光异构体,也称对映异构体。据此化合物![]() 分子中有a种化学环境不同的氢原子,如果用氯取代分子中的氢原子,生成的一氯代物可能有b种,则a、b分别是
分子中有a种化学环境不同的氢原子,如果用氯取代分子中的氢原子,生成的一氯代物可能有b种,则a、b分别是
A.3、6B.4、8C.4、6D.4、12
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:a.C2H2(g)+ H2(g)= C2H4(g)ΔH<0
b. 2CH4(g)= C2H4(g)+ 2H2(g)ΔH>0
判断以下3个热化学方程式:
①C(s)+ 2H2(g)= CH4(g)ΔH1
②C(s)+ ![]() H2(g)=
H2(g)= ![]() C2H2(g)ΔH2
C2H2(g)ΔH2
③C(s)+ H2(g)= ![]() C2H4(g)ΔH3
C2H4(g)ΔH3
ΔH1、ΔH2、ΔH3由大到小的顺序是( )
A. ΔH2 >ΔH3 >ΔH1 B. ΔH3 >ΔH2 >ΔH1
C. ΔH3 >ΔH1 >ΔH2 D. ΔH1 >ΔH2 >ΔH3
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列两套实验装置,用于实验室制取乙酸乙酯和乙酸丁酯。下列说法错误的是
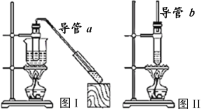
A.导管a和导管b的作用都是冷凝回流
B.都可用饱和Na2CO3溶液来洗去酯中的酸和醇
C.加入过量的乙酸可以提高醇的转化率
D.图I装置用于制取乙酸乙酯,图Ⅱ装置用于制取乙酸丁酯
查看答案和解析>>
科目: 来源: 题型:
【题目】雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O3和NH4NO3产品的流程图如下(Ce为铈元素):

下列说法错误的是
A.Na2S2O4中S元素的化合价为+3
B.装置Ⅱ消耗36 g 水生成4 NA个H+(NA代表阿伏伽德罗常数)
C.装置Ⅲ用甲烷燃料电池进行电解,当消耗24 g 甲烷时,理论上可再生10 mol Ce4+
D.装置Ⅳ获得粗产品NH4NO3的实验操作依次为蒸发浓缩、冷却结晶、过滤、洗涤等。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。已知: ClO2浓度过高或受热易分解,甚至会爆炸。现有下列制备ClO2的方法:
(1)方法一:氧化法
可用亚氯酸钠和稀盐酸为原料制备,反应原理为5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O。
①该反应中氧化剂和还原剂的物质的量之比是_______________________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因__________________________________________________。
(2)方法二:草酸还原法
在酸性溶液中用草酸(H2C2O4)还原氯酸钠的方法来制备ClO2
①写出制备ClO2的离子方程式:__________________________________________;
②与电解法相比,用草酸还原法制备ClO2的特点是____________________,提高了生产、储存及运输过程的安全性。
(3)已知: ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH 的关系如图所示。当pH<2.0 时,ClO2-也能被I- 完全还原为Cl-。反应生成的I2与Na2S2O3 反应的方程式: 2Na2S2O3+ I2= Na2S4O6 + 2NaI。用ClO2消毒的饮用水中含有ClO2、ClO2-。测定饮用水中ClO2、ClO2-的含量,分两步进行:
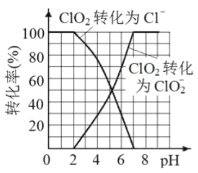
①用紫外分光光度法测得水样中ClO2的含量为a mol/L。
②用滴定法测量ClO2-的含量。请完成相应的实验步骤:
步骤1: 准确量取V mL 上述水样加入锥形瓶中。
步骤2: 调节水样的pH小于2。
步骤3: 加入足量的KI 晶体,充分反应。
步骤4: 加入少量淀粉溶液,用c mol/L Na2S2O3 溶液滴定至终点,消耗Na2S2O3 溶液V1 mL。
根据上述分析数据,测得该饮用水中ClO2-的浓度为___________mol/L( 用含字母的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关水溶液中的平衡相关的问题,请填空
(1)已知常温下,将氯化铝溶液和碳酸钠溶液混合,有白色沉淀产生,写出反应离子方程式______________
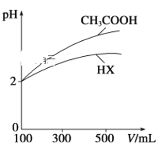
(2)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示。同浓度,同体积的CH3COONa与NaX溶液,离子总数目: CH3COONa溶液_______NaX溶液(填>,<,=)
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
①25℃时,浓度均为0.01 mol·L-1 HCN和NaCN混合溶液显_____性(填酸,碱,中)。溶液中HCN浓度_________CN-浓度(填>,<,=)
②25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中![]() =____。
=____。
(4)在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)____c(Cl-)(填“>” 、“<” 或“=” );用含x和y的代数式表示出氨水的电离平衡常数______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com