
科目: 来源: 题型:
【题目】氢气是一种清洁能源。制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题。
(1)已知; ![]() (g)+H2(g)→
(g)+H2(g)→![]() (g) H=-119.6kJ/mol
(g) H=-119.6kJ/mol
![]() (g)+2H2(g)→
(g)+2H2(g)→![]() (g) H=-237.1kJ/mol
(g) H=-237.1kJ/mol
![]() (g)+3H2(g)→
(g)+3H2(g)→![]() (g) H=-208.4kJ/mol
(g) H=-208.4kJ/mol
请求出![]() (g)+H2(g)→
(g)+H2(g)→![]() (g) H=________kJ/mol
(g) H=________kJ/mol
(2)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢。
![]() (g)
(g)![]()
![]() (g)+3H2(g)
(g)+3H2(g)
在某温度下,向恒容容器中加入环已烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=_______(用含a、b的关系式表达)。
(3)一定条件下,如下图所示装置可实现有机物的电化学储氢(除目标产物外,近似认为无其它有机物生成)。
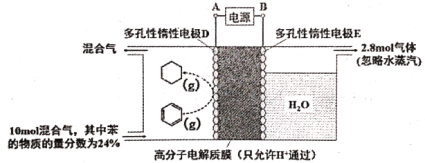
①实现有机物储氢的电极是__________;A 正极 B 负极 C 阴极 D 阳极
其电极反应方程为:___________。
②实验研究表明,当外加电压超过一定值以后,发现电极D产物中苯(g)的体积分数随着电压的增大而减小,其主要原因是相关电极除目标产物外,还有一种单质气体生成,这种气体是__________。已知单质气体为2 mol,求此装置的电流效率η=__________。[η=(生成目标产物消耗的电子数/转移的电子总数)×100%,计算结果保留小数点后1位]。
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,为应对温室气体排放问题和日益增长的能源需求问题,CO2综合利用技术作为潜在的解决方案受到了研究者的广泛关注。请按照要求回答问题
(1)CO常用于工业冶炼金属,下图是在不同温度下CO还原四种金属氧化物达平衡后气体中![]() 与温度(t)的关系曲线图。下列说法正确的是________。(填序号)
与温度(t)的关系曲线图。下列说法正确的是________。(填序号)

A 工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量
B CO不适宜用于工业冶炼金属铬(Cr)
C 工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率
D CO还原PbO2的反应△H>0
(2)一定条件下Pd-Mg/SiO2催化剂可使CO2 “甲烷化”变废为宝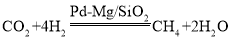 ,最佳催化温度是200℃~300℃左右,超过300℃催化剂会完全失活、反应停止。向密闭容器通入v(CO2):v(H2)=1:4的反应气体,常温进料开始加热,画出生成甲烷的量随温度的变化曲线_________。
,最佳催化温度是200℃~300℃左右,超过300℃催化剂会完全失活、反应停止。向密闭容器通入v(CO2):v(H2)=1:4的反应气体,常温进料开始加热,画出生成甲烷的量随温度的变化曲线_________。
(3)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,则阴极的电极反应式为___________;室温下H2CO3电离常数约为K1=4×10-7,K2=5×10-11,则0.025 mol·L-1的H2CO3溶液的pH约等于__________(不考虑第二步电离和H2O的电离)
查看答案和解析>>
科目: 来源: 题型:
【题目】某废液阳离子只可能含有:Na+、NH4+、Ba2+、Cu2+、Fe2+、Fe3+、Al3+中的某几种,实验设计了下述方案进行处理,以回收金属,保护环境
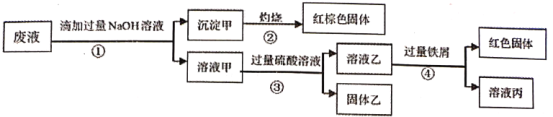
已知:步骤①中,滴加NaOH溶液过程中产生的沉淀会部分溶解,下列说法正确的是:
A.根据步骤①中的现象,说明废液中一定含有Al3+
B.步骤②,由红棕色固体可知,废液中一定存在Fe3+
C.取溶液丙进行焰色反应,焰色为黄色,说明原溶液中一定含Na+
D.该废液一定含有NH4+、Ba2+、Cu2+
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上把Cl2通入冷NaOH溶液中制得漂白液(有效成分为NaClO)。某化学小组在一定温度下将氯气缓缓通入NaOH溶液中,模拟实验得到ClO-、ClO3-等离子的物质的量n(mol)与反应时间t(min)的关系曲线。下列说法错误的是
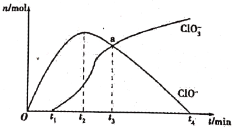
A.参加反应所需NaOH与氯气的物质的量之比一定为2:1
B.a点时溶液中n(NaCl):n(NaClO3):n(NaClO)=6:1:1
C.t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-=2Cl-+ClO3-
D.使用漂白液时,为了增强漂白效果,可以向漂白液中通入二氧化硫
查看答案和解析>>
科目: 来源: 题型:
【题目】侯氏制碱法原理是:NH3+H2O+CO2+NaCl=NaHCO3↓+NH4Cl析出碳酸氢钠,下列实验装置及原理设计说法不合理的是:
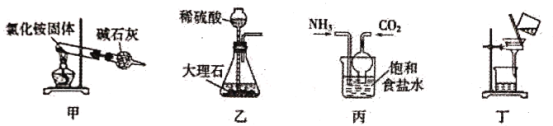
A.用装置甲制取氨气时得到氨气很少,主要原因是分解得到NH3、HCl的遇冷会重新化合
B.用装置乙生成的CO2速率很慢,原因是反应生成微溶于水的硫酸钙,覆盖着大理石的表面
C.用装置丙模拟侯氏制碱法,可以同时通入NH3、CO2,也可以先通氨气再通CO2
D.用装置丁分离得到产品NaHCO3,为得到干燥产品,也可采用减压过滤
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,对可逆反应:2X(g)+Y(g)![]() Z(g)+W(s) ΔH>0的下列叙述正确的是
Z(g)+W(s) ΔH>0的下列叙述正确的是
A.加入少量W,逆反应速度增大
B.升高温度时,正反应速率增大,逆反应速率减小
C.压强不变,充入与反应体系不反应的N2,反应速率减小;体积不变,充入N2,反应速度不变
D.平衡后加入X,上述反应的ΔH增大
查看答案和解析>>
科目: 来源: 题型:
【题目】用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )
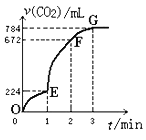
A.F点收集到的CO2的量最多
B.OE段表示的平均速率最快
C.EF段用盐酸表示该反应的平均反应速率为0.4mol·L-1min-1
D.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作或试剂的选择都合理的是
A.减压过滤时,常用倾析法先转移上部清液,溶液量不超过漏斗容量的2/3,慢慢开大水龙头,待溶液快流尽时再转移下部沉淀
B.用酸性高锰酸钾溶液检验FeCl2和FeCl3混合液中的Fe2+
C.用NaOH溶液除去溶在乙酸乙酯中的乙酸
D.向CoCl2溶液中逐滴加入浓盐酸并振荡,溶液的颜色会从蓝色逐渐变成粉红色
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+B(g) ![]() 2C(g)+D(g)。若最初加入的A和B都是8 mol,在前10秒钟A的平均反应速率为0.12 mol/(Ls),则10秒钟时,容器中B的物质的量是
2C(g)+D(g)。若最初加入的A和B都是8 mol,在前10秒钟A的平均反应速率为0.12 mol/(Ls),则10秒钟时,容器中B的物质的量是
A.5.6 molB.6.8 molC.2.4 molD.3.2 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】在2A+B ![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.v(A)=2 mol·L-1·s-1B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1D.v(D)=1 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com