
科目: 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和 2molB进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
A.该反应的化学平衡常数表达式是 K=![]()
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加 B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸.下列离子方程式可能与事实相符的是
A.OH﹣+2CO32﹣+3H+→2HCO3﹣+H2O
B.2OH﹣+CO32﹣+3H+→HCO3﹣+2H2O
C.2OH﹣+CO32﹣+4H+→CO2↑+3H2O
D.OH﹣+CO32﹣+3H+→CO2↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O(g)=CO(g)△H1;C(s)+![]() O2(g)=CO(g)△H2
O2(g)=CO(g)△H2
②S(s)+O2(g)=SO2(g)△H3;S(g)+O2(g)=SO2(g)△H4
③H2(g)+![]() O2(g)=H2O(l)△H5;2H2(g)+O2(g)=2H2O(l)△H6
O2(g)=H2O(l)△H5;2H2(g)+O2(g)=2H2O(l)△H6
④CaCO3(s)=CaO(s)+CO2(g)△H7;CaO(s)+H2O(l)=Ca(OH)2(s)△H8
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将 0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H = -38.6kJ·mol-1
2NH3(g) △H = -38.6kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H=-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1
D.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1) △H =-571.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中一定正确的是
A.0.1mol/L的CH3COOH溶液中,由水电离出的c(H+)为10﹣13 mol/L
B.pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10
C.仅含有Na+、H+、OH﹣、CH3COO﹣四种离子的某溶液中可能存在:c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
D.1.0 molL﹣1Na2CO3溶液:c(OH﹣)=c(HCO3﹣)+c(H+)+2c(H2CO3)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
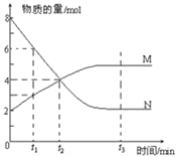
(1)该反应的化学方程式是_____________________________
(2)在图上所示的三个时刻中___________(填t1、t2或t3)时刻处于平衡状态,此时v正________v逆(填>、<或=);达到平衡状态后,平均反应速率v(N):v(M)=___________
(3)若反应容器的容积不变,则“压强不再改变”_________(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是________(选填字母) A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
(5)向一个容积为4L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,发生如下反应:2SO2(g)+O22SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,则以O2表示的反应速率为________;平衡时SO3的物质的量浓度________
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________。直到因加入一滴盐酸后,溶液由黄色变为橙色,并________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(____)。
A 酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B 滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C 酸式滴定管在滴定前有气泡,滴定后气泡消失
D 读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
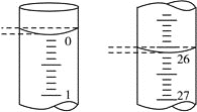
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL;所用盐酸溶液的体积为________mL。
(4)某学生根据3次实验分别记录有关数据如表:
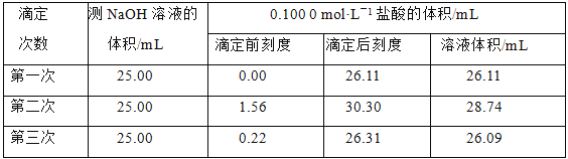
依据上表数据列式计算该NaOH溶液的物质的量浓度_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )
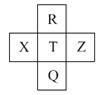
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R<T<Q
D.最高价氧化物的水化物的酸性:R>Q
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中的a和b为氢镍可充电碱性电池的电极,该电池总反应式为2Ni(OH)2![]() H2+2NiO(OH)。
H2+2NiO(OH)。
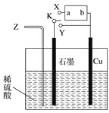
(1)为了实现铜与稀硫酸反应,用Z通入氧气的同时,将开关K与Y相连即可。石墨电极的反应式为______________________________,总反应的化学方程式为________________________________________;
(2)不通入氧气,直接将K与X相连也能实现铜与稀硫酸反应。则氢镍碱性电池的负极为________(填“a”或“b”),电解槽内总反应的离子方程式为_____________________________________________;
(3)当给氢镍碱性电池充电时,该电池的阳极反应式为__________________,氢镍电池放电时,负极附近的pH会________(填“变大”、“不变”或“变小”);
(4)若将图中的稀硫酸换成CuSO4溶液,并且将氢镍碱性电池的电极反接,将K连接X,通电一段时间后,向所得溶液中加入0.2 mol碱式碳酸铜[Cu2(OH)2CO3]后,恰好恢复到原来的浓度和pH(不考虑CO2的溶解),则电解过程中转移电子的物质的量为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)D的元素符号为______。A的单质分子中π键的个数为______。
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是__________________________________。
(3)A、B、C 3种元素的第一电离能由大到小的顺序为________(用元素符号表示)。
(4)写出基态E原子的价电子排布式:__________________。

(5)A的最简单氢化物分子的空间构型为________,其中A原子的杂化类型是________。
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,求晶胞边长a=________cm。(用ρ、NA的计算式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com