
科目: 来源: 题型:
【题目】乙二酸,又称草酸,通常在空气中易被氧化而变质。其两分子结晶水(H2C2O4·2H2O)却能在空气中稳定存在。在分析化学中常用H2C2O4·2H2O做KMnO4的滴定剂,下列关于H2C2O4的说法正确的是
A.草酸是二元弱酸,其电离方程式为H2C2O4![]() 2H++C2O
2H++C2O![]()
B.草酸滴定KMnO4属于中和滴定,可用石蕊做指示剂
C.乙二酸可通过乙烯经过加成、水解、氧化再氧化制得
D.将浓H2SO4滴加到乙二酸上使之脱水分解,分解产物是CO2和H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构为: ,有关原花青素的下列说法不正确的是( )
,有关原花青素的下列说法不正确的是( )
A.该物质既可看作醇类,也可看作酚类
B.1mol该物质可与4molBr2反应
C.1mol该物质可与7molNa反应
D.1mol该物质可与7molNaOH反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
a | |||||||||||||||||
b | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o | p |
(1)在周期表中,与元素b的化学性质最相似的邻族元素是________(填写以上表中字母对应的元素符号),该元素基态原子核外M层电子的自旋状态________(填“相同”或“相反”)。
(2)元素As与________同族(填写以上表中字母对应的元素符号),其简单气态氢化物的稳定性由大到小的顺序是________。
(3)基态ρ原子成为阳离子时首先失去________轨道电子,基态![]() 的最外层电子排布式________。
的最外层电子排布式________。
(4)i的最高价氧化物对应的水化物与g的最高价氧化物对应的水化物反应的离子方程式为________________。
(5)下列关于上图表中元素说法正确的是________(填序号)。
①未成对电子数最多的元素是O
②元素的电负性强弱;![]()
③元素的第一电离能:![]()
④简单离子半径:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】A~F都是有机化合物,它们的转化关系如下:
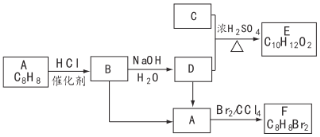
请回答下列问题:
(1)化合物C中含有官能团的名称为________,A为一取代芳香烃,共面的碳原子最多有________个。
(2)D中含有一个甲基,由B生成D的化学方程式为________。
(3)由A生成B的反应类型为________。
(4)由B生成A的反应条件是________。
(5)E存在于栀子香油中,其结构简式为________。
(5)在F的同分异构体中,苯环上一硝化产物只有一种,核磁共振有两组峰且峰面积比为![]() 的是________(填结构简式)。
的是________(填结构简式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某反应体系中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种微粒,反应过程中测得ClO- 和N2的物质的量随时间的变化如下图所示。有关判断正确的是
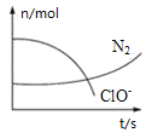
A.氧化剂是ClO-,还原产物是HCO3-
B.反应体系中反应物与生成物各有三种微粒
C.氧化剂与还原剂的物质的量之比为5∶2
D.生成2.24L N2(标准状况)时转移电子0.5 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】“中和滴定”原理在实际生产生活中应用广泛。用![]() 可定量测定CO的含量,该反应原理为
可定量测定CO的含量,该反应原理为![]() ,其实验步骤如下:
,其实验步骤如下:
①取200 mL(标准状况)含有CO的某气体样品通过盛有足量![]() 的硬质玻璃管中在170℃下充分反应:
的硬质玻璃管中在170℃下充分反应:
②用酒精溶液充分溶解产物![]() ,配制100 mL溶液;
,配制100 mL溶液;
③量取步骤②中溶液20.00 mL于锥形瓶中,然后用![]() 的
的![]() 标准溶液滴定,发生反应为
标准溶液滴定,发生反应为![]() 。消耗标准
。消耗标准![]() 溶液的体积如表所示。
溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 1.10 | 1.50 | 2.40 |
滴定后读数/mL | 21.00 | 21.50 | 22.50 |
(1)步骤②中配制100 mL待测液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和________。
(2)![]() 标准液应装在________(填“酸式”“碱式”)滴定管中。
标准液应装在________(填“酸式”“碱式”)滴定管中。
(3)指示剂应选用________,判断达到滴定终点的现象是________。
(4)气体样品中CO的体积分数为________(已知气体样品中其他成分不与![]() 反应)
反应)
(5)下列操作会造成所测CO的体积分数偏大的是________(填字母)。
a.滴定终点时仰视读数
b.滴定前尖嘴外无气泡,滴定后有气泡
C.配制100 mL待测溶液时,有少量溅出。
d.锥形瓶用待测溶液润洗
查看答案和解析>>
科目: 来源: 题型:
【题目】尿素燃料电池既能去除城市废水中的尿素,又能发电。尿素燃料电池结构如下图所示,甲电极上发生如下反应:CO(NH2)2+ H2O-6e-→CO2+N2+6H+,则
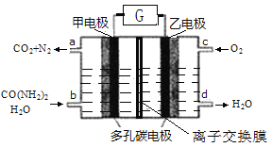
A.甲电极是阴极
B.电解质溶液可以是KOH溶液
C.H+从甲电极附近向乙电极附近迁移
D.每2molO2理论上可净化1molCO(NH2)2
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年12月20日,美国总统特朗普签署了2020财政年度国防授权法案,对俄罗斯向欧洲进行天然气输出的“北溪2号”管道项目实施制裁,实施“美国优先发展战略”。天然气既是一种优质能源,又是一种重要化工原料,甲烧水蒸气催化重整制备高纯氢是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,已知在反应器中存在如下反应过程:
Ⅰ.![]()
Ⅱ.![]()
根据上述信息请写出甲烷水蒸气催化重整的热化学反方程式:________________。
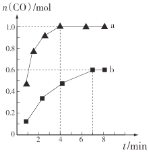
(2)在一定条件下向a、b两个恒温恒容的密闭容器中均通入![]() 和
和![]() ,利用反应Ⅰ制备
,利用反应Ⅰ制备![]() ,测得两容器中CO的物质的量随时间的变化曲线分别为a和b(已知容器a、b的体积为2 L)。
,测得两容器中CO的物质的量随时间的变化曲线分别为a和b(已知容器a、b的体积为2 L)。
则a、b两容器的温度________(填“相同”“不相同”或“不确定”);在达到平衡前,容器a的压强________(填“逐渐增大”“不变”或“逐渐减小”);容器a中![]() 从反应开始到恰好平衡时的平均反应速率为________,在该温度下反应的化学平衡常数K=________。
从反应开始到恰好平衡时的平均反应速率为________,在该温度下反应的化学平衡常数K=________。
(3)某氢氧燃料电池以熔融态的碳酸盐为电解质,其中![]() 参与电极反应。工作时负极的电极反应为
参与电极反应。工作时负极的电极反应为![]() 。如图所示,根据相关信息回答下列问题:
。如图所示,根据相关信息回答下列问题:
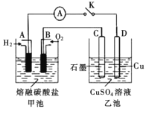
①正极的电极反应为________;
②当甲池中A电极理论上消耗![]() 的体积为448 mL(标准状况)时,乙池中C、D两电极质量变化量之差为________g。
的体积为448 mL(标准状况)时,乙池中C、D两电极质量变化量之差为________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有以下几种有机物:
①![]() ②
②![]() ③
③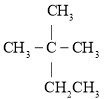 ④
④![]() ⑤
⑤![]()
⑥![]() ⑦
⑦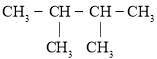 ⑧
⑧![]() ⑨
⑨ ![]()
请利用上述给出的物质按要求回答下列问题:
(1)③的系统命名是________。
(2)用“>”表示①③④⑧熔沸点高低顺序:________(填序号)。
(3)与③互为同系物的是________(填序号)。
(4)⑨的一氯代物同分异构体数目有________种。
(5)在120℃,![]() 条件下,某种气态烃与足量的
条件下,某种气态烃与足量的![]() 完全反应后,测得反应前后气体的体积没有发生改变,则该烃是________(填序号)。
完全反应后,测得反应前后气体的体积没有发生改变,则该烃是________(填序号)。
(6)写出⑥在铁作催化剂的条件下与液溴发生取代反应的化学方程式________。
(7)②在加热条件下和CuO反应的化学方程式________。
(8)②和⑤发生反应的化学方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)元素Zn位于元素周期表的________族、________区;基态Zn原子价层电子的电子排布图(轨道表示式)为________。
(2)基态Zn原子核外电子占据最高能层的符号是________,占据该能层电子的电子云轮廓图形状为________形。
(3)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第一电离能![]() __________
__________![]() (填“大于”或“小于”)。原因是________________。
(填“大于”或“小于”)。原因是________________。
(4)光催化还原![]() 制备
制备![]() 反应中,带状纳米
反应中,带状纳米![]() 是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________。
是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com