
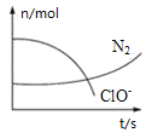
【题目】某反应体系中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种微粒,反应过程中测得ClO- 和N2的物质的量随时间的变化如下图所示。有关判断正确的是
A.氧化剂是ClO-,还原产物是HCO3-
B.反应体系中反应物与生成物各有三种微粒
C.氧化剂与还原剂的物质的量之比为5∶2
D.生成2.24L N2(标准状况)时转移电子0.5 mol
【答案】BC
【解析】
由曲线变化图可知,随反应进行![]() 的物质的量降低,
的物质的量降低,![]() 的物质的量增大,故C
的物质的量增大,故C![]() 为反应物,
为反应物,![]() 是生成物,根据电子转移相等可知,
是生成物,根据电子转移相等可知,![]() 是反应物,由氯元素守恒可知
是反应物,由氯元素守恒可知![]() 是生成物,由碳元素守恒可知
是生成物,由碳元素守恒可知![]() 是生成物,由氢元素守恒可知
是生成物,由氢元素守恒可知![]() 是反应物.反应中Cl元素化合价由
是反应物.反应中Cl元素化合价由![]() 价降低为
价降低为![]() 价,化合价总共降低2价,C元素化合价由
价,化合价总共降低2价,C元素化合价由![]() 价升高为
价升高为![]() 价,N元素化合价由
价,N元素化合价由![]() 价升高为0价,化合价总共升高
价升高为0价,化合价总共升高![]() 价,故C
价,故C![]() 系数为2,
系数为2,![]() 系数为5,由元素守恒可知
系数为5,由元素守恒可知![]() 系数为2,
系数为2,![]() 系数为1,
系数为1,![]() 系数为5,
系数为5,![]() 系数为1,反应方程式为
系数为1,反应方程式为![]() 。
。
A.反应中Cl元素化合价由![]() 中
中![]() 价降低为
价降低为![]() 中
中![]() 价,
价,![]() 是氧化剂,还原产物是
是氧化剂,还原产物是![]() ,A错误;
,A错误;
B.由![]() 可知,B正确;
可知,B正确;
C.由上述分析可知,反应为![]() ,反应中是
,反应中是![]() 是还原剂,
是还原剂,![]() 是氧化剂,氧化剂与还原剂的化学计量数之比为5:2,C正确;
是氧化剂,氧化剂与还原剂的化学计量数之比为5:2,C正确;
D.![]() 标准状况
标准状况![]() 的物质的量为
的物质的量为![]() ,所以参加反应的
,所以参加反应的![]() 的物质的量为
的物质的量为![]() ,反应中只有氯元素化合价降低,由
,反应中只有氯元素化合价降低,由![]() 中
中![]() 价降低为
价降低为![]() 中
中![]() 价,所以转移电子数为
价,所以转移电子数为![]() ,D错误。
,D错误。
故选BC。


科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并使产生的气体全部通过如图所示装置中,得到如表中所列的实验结果(假设产生的气体完全被吸收)。
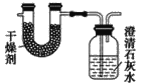
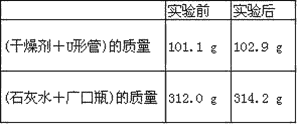
根据实验数据求:
(1)实验完毕后,生成物中水的质量为________g。假设广口瓶里生成一种正盐,其质量为_____________g。
(2)生成的水中氢元素的质量为_______g。
(3)生成的二氧化碳中碳元素的质量为_______ g。
(4)该燃料中碳元素与氢元素的质量比为_______。
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为_______,结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】港珠澳大桥设计寿命达120年,对桥体钢构件采用的主要的防腐方法有:①铜梁上安装铝片;②使用高性能富锌(富含锌粉)底漆;③使用高附着性防腐涂料;④预留钢铁腐蚀量。下列分析不正确的是( )
A.①②防腐原理是牺牲阳极的阴极保护法
B.方法①②③只能减缓钢铁腐蚀,未能完全消除
C.钢铁发生吸氧腐蚀时的负极反应式为:![]()
D.防腐涂料可以防水、隔绝空气,降低钢铁在海水中析氢腐蚀速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)元素Zn位于元素周期表的________族、________区;基态Zn原子价层电子的电子排布图(轨道表示式)为________。
(2)基态Zn原子核外电子占据最高能层的符号是________,占据该能层电子的电子云轮廓图形状为________形。
(3)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第一电离能![]() __________
__________![]() (填“大于”或“小于”)。原因是________________。
(填“大于”或“小于”)。原因是________________。
(4)光催化还原![]() 制备
制备![]() 反应中,带状纳米
反应中,带状纳米![]() 是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________。
是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料,下列关于聚乙炔的叙述错误的是( )
A. 聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
B. 聚乙炔的化学式为![]()
C. 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D. 聚乙炔树脂不加任何填充物即可成为电的良导体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):

已知:①E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同化学环境的氢原子,其个数比为3∶1;

(R、R′、R″代表相同或不相同的烃基)。
(1)A分子中的含氧官能团的名称是________________。
(2)D→E反应的化学方程式是____________。
(3)A→B反应所需的试剂是________________。
(4)G→H反应的化学方程式是____________。
(5)已知1 mol E与2 mol J反应生成1 mol M,则M的结构简式是________。
(6)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有________种,其中任意1种的结构简式是________。
(7)J可合成高分子化合物,该高分子化合物的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢溴酸是无色、易挥发的液体,在化工领域用途广泛。实验室模拟一种工业制备氢溴酸的主要流程如下:
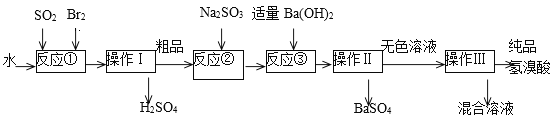
(1)写出反应①的离子方程式___________该反应需要在冰水浴中进行,可能的原因是____________。
(2)操作I的名称__________。
(3)反应②中Na2SO3的目的是_____________________。
(4)操作Ⅱ用到的玻璃仪器有烧杯、_____________________。
(5)工业生产中制得的氢溴酸带有淡淡的黄色。于是甲乙两同学设计了实验加以探究:
①甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为_________,若假设成立可观察到的现象为____________________。
②乙同学假设工业氢溴酸呈淡黄色是因为____,其用于证明该假设成立的方法为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c(![]() )>c(
)>c(![]() )>c(Fe2+)>c(H+)
)>c(Fe2+)>c(H+)
B.pH=11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C.在0.1 mol·L-1 Na2CO3溶液中:2c(Na+)=c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
D.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性:c(CH3COO-)> c(Cl-)> c(CH3COOH)> c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com