
科目: 来源: 题型:
【题目】乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O ,相对分子质量为288)易溶于水,是一种很好的补铁剂,可由乳酸[CH3CH(OH)COOH]与FeCO3反应制得。I.碳酸亚铁的制备(装置如图所示)
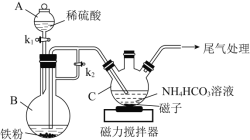
(1)仪器B的名称是______;实验操作如下:打开k1、k2,加入适量稀硫酸,关闭k1,使反应进行一段时间,其目的是______。
(2)接下来要使仪器C中的制备反应发生,需要进行的操作是______,其反应的离子方程式为______。
(3)仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是____。
Ⅱ乳酸亚铁的制备及铁元素含量测定
(4)向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在______的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
(5)两位同学分别用不同的方案进行铁元素含量测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于100%,其原因可能是______
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成100mL溶液。吸取 25.00mL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0.100 mol·L-1硫代硫酸钠溶液滴定(已知: I2+2S2O32-=S4O62-+2I-),当溶液______ ,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24.80 mL,则样品纯度为______ %保留1位小数 。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温时,用0.0200mol/L稀盐酸滴定20.00mL0.0200mol/LNaY溶液,溶液中水的电离程度随所加稀盐酸的体积变化如图所示(忽略滴定过程中溶液的体积变化),则下列有关说法正确的是
已知:K(HY)=5.0×10-11
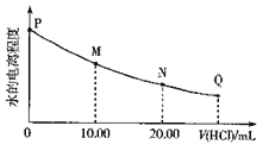
A. 可选取酚酞作为滴定指示剂 B. M点溶液的pH>7
C. 图中Q点水的电离程度最小,Kw<10-14 D. M点,c(Na+)=c(HY)+c(Y-)+c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构,受热易分解,层内的H3BO3分子通过氢键相连(如图所示),则下列有关说法中不正确的是

A. 正硼酸晶体属于分子晶体
B. 正硼酸分子的稳定性与氢键无关
C. 1molH3BO3晶体中含有3mol氢键
D. B原子杂化轨道的类型sp2,层间的H3BO3分子通过共价键相连
查看答案和解析>>
科目: 来源: 题型:
【题目】利用CH4燃料电池电解制备Ca(H2PO4)2并得到副产物NaOH、H2、Cl2,装置如图所示。下列说法正确的是
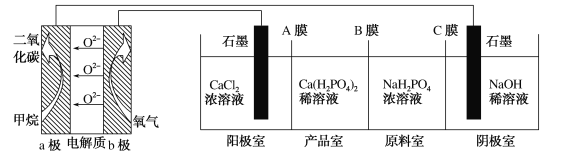
A.a极反应:CH4+8e-+4O2-=CO2+2H2O
B.A膜和C膜均为阴离子交换膜
C.可用铁电极替换阴极的石墨电极
D.a极上通入2.24 L甲烷,阳极室Ca2+减少0.4 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】为达到下列实验目的,对应的实验方法以及相关解释均正确的是
选项 | 实验目的 | 实验方法 | 相关解释 |
A | 测量氯水的pH |
| pH试纸遇酸变红 |
B | 探究正戊烷C5H12催化裂解 |
| C5H12裂解为分子较小的烷烃和烯烃 |
C | 实验温度对平衡移动的影响 |
| 2NO2 |
D | 用AlCl3溶液制备AlCl3晶体 |
| AlCl3沸点高于溶剂水 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】一种形状像蝴蝶结的有机分子Bowtiediene,其形状和结构如图所示,下列有关该分子的说法中错误的是

A. 生成1 mol C5 H12至少需要4 mol H2
B. 该分子中所有碳原子在同一平面内
C. 三氯代物只有一种
D. 与其互为同分异构体,且只含碳碳三键的链烃有两种
查看答案和解析>>
科目: 来源: 题型:
【题目】磷化硼是一种超硬耐磨涂层材料,右图为其晶胞,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )

A. 磷化硼晶体中每个原子均形成4条共价键
B. 磷化硼晶体的化学式为BP,属于离子晶体
C. 磷化硼晶体的熔点很低
D. 磷化硼晶体结构中微粒的空间堆积方式与氯化钠晶体相同
查看答案和解析>>
科目: 来源: 题型:
【题目】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
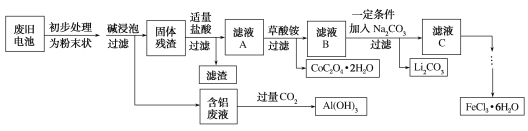
已知:①还原性:Cl->Co2+;
②Fe3+和![]() 结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是________。
(2)从含铝废液得到Al(OH)3的离子方程式为___________
(3)滤液A中的溶质除HCl、LiCl外还有________(填化学式)。写出LiCoO2和盐酸反应的化学方程式____________
(4)滤渣的主要成分为_______(填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
Ⅰ | 120~220 | CoC2O4·2H2O CoC2O4+2H2O | 19.67% |
Ⅱ | 300~350 | ______ | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02 mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为________ mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】奥美拉唑主要用于十二指肠溃疡和胃溃的治疗,静脉注射可用于消化性溃疡急性出血的治疗,反应中间体F和奥美拉唑的合成路线如图:
I>中间体F的合成:
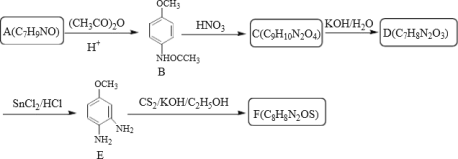
II.奧美拉唑的合成:
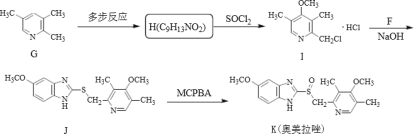
已知:R-OH![]() R-Cl
R-Cl
R1-SH+R2-X![]() R1-S-R2
R1-S-R2
结合上述合成路线,请回答:
(1)下列说法正确的是_____。
A.奥美拉唑的分子式为C18H19N3O3S
B.J生成K的反应类型为加成反应
C.化合物C可以发生的反应类型有取代、还原、加成
D.设计A转化为B的目的是保护其中的官能团
(2)化合物F的结构简式为_____;
(3)请写出A→B的反应方程式_____;
(4)试写出同时满足下列条件的化合物H的同分异构体:_____。
①分子中含苯环,遇FeC13显紫色
②分子中含有4种不同化学环境的氢原子。
(5)利用已有知识和题中涉及的反应,设计从乙烯合成![]() 的路线_____。(用流程图表示,无机试剂任选)
的路线_____。(用流程图表示,无机试剂任选)
查看答案和解析>>
科目: 来源: 题型:
【题目】四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是(假设金属的摩尔质量为Mg·mol-1金属原子半径为r cm,用NA表示阿伏加德罗常数的值)

A.金属Zn采用②堆积方式
B.①和③中原子的配位数分别为:6、8
C.对于采用②堆积方式的金属的晶胞质量为![]()
D.金属锻压时,会破坏密堆积的排列方式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com