
科目: 来源: 题型:
【题目】有机物K是某药物的合成中间体,其合成路线如图所示:

已知:①HBr与不对称烯桂加成时,在过氧化物作用下,则卤原子连接到含氢较多的双键碳上;
②R—CN![]() R-CH2NH2(R表示坯基);
R-CH2NH2(R表示坯基);
③R1—CN2+R-COOC2H5![]()
![]() +C2H5OH(R表示烃基或氢原子)。
+C2H5OH(R表示烃基或氢原子)。
请回答下列问题:
(1)C的化学名称为_______________。
(2)D→E的反应类型为_________,F中官能团的名称是____________。
(3)G→H的化学方程式为____________________。
(4)J的分子式为__________________。手性碳原子是指与四个各不相同原子或基团相连的碳原子,则K分子中的手性碳原子数目为_______。
(5)L是F的同分异构体,则满足下列条件的L的结构简式为____________。(任写一种结构即可)
①lmolL与足量的NaHCO3溶液反应能生成2molCO2;
②L的核磁共振氢谱有3组峰且峰面积之比为1:2:3。
(6)请写出J经三步反应合成K的合成路线:____________________(无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯甲酸(![]() )是重要的化工原料,可应用于消毒防腐、染料载体、增塑剂、香料及食品防腐剂的生产,也可用于钢铁设备的防锈剂。某化学实验小组在实验室中以苯甲醛为原料制取苯甲酸和副产品苯甲醇(
)是重要的化工原料,可应用于消毒防腐、染料载体、增塑剂、香料及食品防腐剂的生产,也可用于钢铁设备的防锈剂。某化学实验小组在实验室中以苯甲醛为原料制取苯甲酸和副产品苯甲醇(![]() )的实验流程:
)的实验流程:
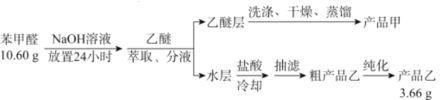
已知:① ;
;![]() ;
; (R、R1表示烃基或氢原子)
(R、R1表示烃基或氢原子)
②相关物质的部分物理性质见表:
名称 | 相对密度 | 熔点/℃ | 沸点/℃ | 溶解度 | |
水 | 乙醚 | ||||
苯甲醛 | 1.04 | -26 | 179.6 | 微溶 | 易溶 |
苯甲酸 | 1.27 | 122.1 | 249 | 25℃微溶,95℃可溶 | 易溶 |
苯甲醇 | 1.04 | -15.3 | 205.7 | 微溶 | 易溶 |
乙醚 | 0.71 | -116.3 | 34.6 | 不溶 | — |
请回答下列问题:
(1)进行萃取、分液操作时所用玻璃仪器的名称为___________。分液时,乙醚层应从_______(填“下口放出”或“上口倒出”)。
(2)洗涤乙醚层时需要依次用NaHSO3溶液、10%Na2CO3溶液、蒸馏水进行洗涤。其中加入NaHSO3溶液洗涤的主要目的是________________,对应的化学方程式为___________________________。
(3)蒸馏获得产品甲时加入碎瓷片的目的为_____________,蒸馏时应控制温度在____℃左右。
A.34.6 B.179.6 C.205.7 D.249
(4)提纯粗产品乙获得产品乙的纯化方法名称为________________。
(5)称取10.60g的苯甲醛进行实验,最终制取产品乙的质量为3.66g,则产品乙的产率为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】第四周期元素Q位于ds区,最外层电子半充满;短周期元素W、X、Y、Z第一电离能与原子序数的关系如下图所示,请回答下列问题(用Q、W、X、Y、Z所对应的元素符号作答):
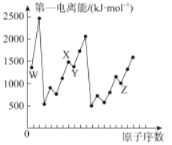
(1)基态Y原子核外共有___种运动状态不相同的电子。若用n表示能层,则与Y元素同族的元素的基态原子的价电子排布式为_________________。
(2)X、W组成的一种二元化合物常用作火箭燃料,该化合物中X原子的杂化方式为___________。该化合物常温下呈液态,其沸点高于Y2沸点的原因为___________。
(3)X2Y曾被用作麻醉剂,根据“等电子体原理”预测X2Y的空间构型为______________。
(4)XW3存在孤电子对,可形成[Q(XW3)4]2+离子,该离子中不存在_____________(填序号)。
A.极性共价键 B.非极性共价键 C.配位键 D.σ键 E.π键
(5)Q与X形成的一种二元化合物的立方晶胞结构如图所示:
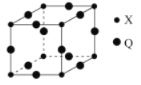
①Q原子周围距其距离最近的Q原子的数目为_______。
②该二元化合物的化学式为___________________。
(6)已知单质Q晶体的堆积方式为面心立方最密堆积,则单质Q晶体的晶胞中原子的空间利用率为_________________(用含π的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在1L恒容密闭容器中,发生反应2NO(g)+O2(g)![]() 2NO2(g)。
2NO2(g)。
(1)某温度时,按物质的量比2:1充入NO和O2开始反应,n(NO)随时间变化如表:
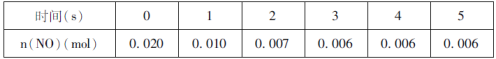
以O2浓度变化表示的反应速率,0~4s内的________(填“小于”、“大于”或“等于”)1~5s内的。
(2)该反应的平衡常数表达式为K=________,能说明该反应已达到平衡状态的是________。
A.气体颜色保持不变 B.气体平均相对分子质量保持不变
C.v逆(NO)=2v正(O2) D.气体密度保持不变
(3)已知:K(300℃)>K(400℃)。下列措施能使该反应的反应速率增大且平衡向正反应方向移动的是________。
A.升高温度 B.充入Ar使压强增大 C.充入O2使压强增大 D.选择高效催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ·mol-1。则相同条件下破坏1 mol NO中的化学键需要吸收的能量为________kJ。
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=________mol·L-1;往溶液中加入少量NaOH固体,则溶液中![]() ___________(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:________。
___________(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:________。
(3)25℃时,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。
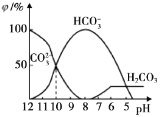
①在同一溶液中,H2CO3、HCO3-、CO32-____________(填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的微粒主要为___________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=___________。
HCO3-+OH-的平衡常数Kh=___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:

分析图像,以下结论错误的是( )
A. 析氢腐蚀和吸氧腐蚀的速率一样快
B. 在酸性溶液中生铁可能发生吸氧腐蚀
C. 溶液pH≤2时,生铁发生析氢腐蚀
D. 两溶液中负极反应均为Fe – 2e- = Fe2+
查看答案和解析>>
科目: 来源: 题型:
【题目】甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。
(1)已知热化学反应方程式:
I:HCOOH(g)![]() CO(g)+H2O(g) △H1=+72.6kJmol-1;
CO(g)+H2O(g) △H1=+72.6kJmol-1;
II:2CO(g)+O2(g)![]() 2CO2(g) △H 2=-566.0kJmol-1;
2CO2(g) △H 2=-566.0kJmol-1;
III:2H2(g)+O2(g)![]() 2H2O(g) △H 3=-483.6kJmol-1
2H2O(g) △H 3=-483.6kJmol-1
则反应IV:CO2(g)+H2(g)![]() HCOOH(g)的△H =____________kJmol-1。
HCOOH(g)的△H =____________kJmol-1。
(2)查阅资料知在过渡金属催化剂存在下,CO2(g)和H2 (g)合成HCOOH(g)的反应分两步进行:第一步:CO2(g)+H2(g)+M(s)→MHCOOH(s);第二步:___________________。
①第一步反应的△H _________0(填“>”或“<”)。
②第二步反应的方程式为________________________。
③在起始温度、体积都相同的甲、乙两个密闭容器中分别投入完全相同的H2(g)和CO2(g),甲容器保持恒温恒容,乙容器保持绝热恒容,经测定,两个容器分别在t1、t2时刻恰好达到平衡,则t1_________t2(填“>”、“<”或“=”)。
(3)在体积为1L的恒容密闭容器中,起始投料n(CO2)=1mol,以CO2(g)和H2(g)为原料合成HCOOH(g),HCOOH平衡时的体积分数随投料比[ ]的变化如图所示:
]的变化如图所示:
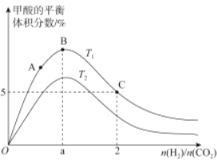
①图中T1、T2表示不同的反应温度,判断T1____________T2(填“〉”、“<”或“=” ) ,依据为____________________。
②图中a=______________。
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为____________。
④T1温度下,该反应的平衡常数K=______________(计算结果用分数表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用石墨电极完成下列电解实验。
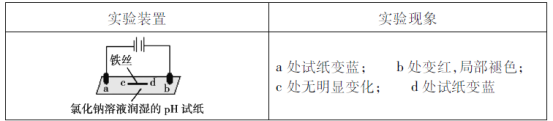
下列对实验现象的解释或推测不合理的是
A.a为电解池的阴极
B.b处有氯气生成,且与水反应生成了盐酸和次氯酸
C.c处发生了反应:Fe-3e-=Fe3+
D.d处:2H2O+2e-=H2↑+2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,分别用0.1000molL-1的NaOH标准液滴定浓度均为0.1molL-1的三种酸HX、HY、和HZ,滴定曲线如图所示,下列说法错误的是

A.三种酸的酸性强弱:HX>HY>HZ
B.等浓度、等体积的HY溶液和NaY溶液混合,混合液显酸性
C.用NaOH标准液滴定HZ溶液时,选用酚酞作指示剂
D.滴定HX的曲线中,当中和百分数为50%时,溶液中存在c(X-)<c(Na+)
查看答案和解析>>
科目: 来源: 题型:
【题目】在固定容积的密闭容器中,A和B发生下列反应:A(s)+2B(g)![]() 2C(g) △H>0,在一定条件下达到平衡,若升高温度则达平衡后混合气体的
2C(g) △H>0,在一定条件下达到平衡,若升高温度则达平衡后混合气体的
A.气体的分子数减少B.A的物质的量浓度减小
C.气体的密度减小D.气体的平均相对分子质量增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com