
科目: 来源: 题型:
【题目】下列研究目的和示意图相符的是( )
选项 | A | B | C | D |
研究目的 | 密闭容器中,压强对反应:2SO2(g)+O2(g) | 固定容积的密闭容器中,温度对反应:N2(g)+3H2(g) | 等质量Na、K分别与足量水反应 | 固定容积的密闭容器中,增大CO2浓度,对已达平衡的反应:CO(g)+H2O(g) |
示意图 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g)达到平衡。下列说法正确的是( )
CH3OH(g)达到平衡。下列说法正确的是( )
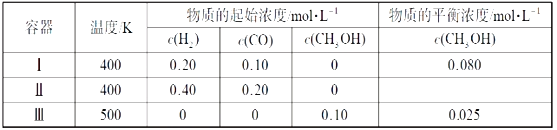
A.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
B.该反应的正反应放热
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的小
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化锰无论在实验室还是在生产、生活中均有广泛应用。工业上可以用制备对苯二酚的废液为原料生产二氧化锰。此工艺对节约资源、保护环境、提高经济效益有着重要意义。
(1)经分析知该废液中含有硫酸锰、硫酸铵、硫酸以及Fe2+、Co2+、Ni2+等金属离子。以此为原料制备化学二氧化锰的流程如图所示。
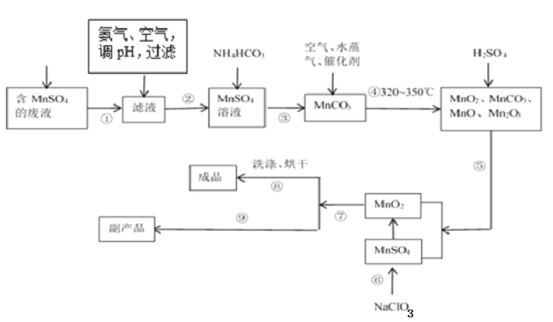
①常温下几种有关难溶硫化物的溶度积常数如下表,若除去Fe2+后的废液中Mn2+浓度为1mol/L,欲使Co2+和Ni2+完全沉淀,而Mn2+不受损失,S2-的浓度范围应控制在___mol/L。
化合物 | MnS | CoS(α型) | NiS |
Ksp | 2.5×10-10 | 4×10-21 | 1.07×10-21 |
②步骤⑥的化学方程式为___。
③步骤①~⑨中涉及到过滤的操作有___。(填序号)
④步骤⑨得到的副产品的化学式为___,其重要的用途之一是___。得到该副产品的操作是___。
(2)生产电解二氧化锰的原理是在93℃左右以石墨为电极电解硫酸锰和硫酸的混合溶液,写出阳极的电极反应式___,若电解过程中的电压为3V,理论上生产1tMnO2消耗电能___kw·h。(1kw·h=3.6×106J)
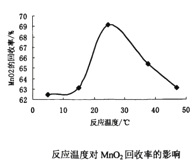
(3)双氧水氧化法制备二氧化锰时所发生的反应为MnSO4+2NH3+H2O2→MnO2+(NH4)2SO4,在溶液的pH、过氧化氢的用量和反应时间一定的情况下,温度对实验结果的影响如图所示。MnO2的回收率随着温度升高先增大后减小的可能原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】常见含硫物质A~D,在生活、生产中有着广泛应用,它们之间的转化关系如下图所示。其中反应①、②中所需物质B溶液的浓度不同。
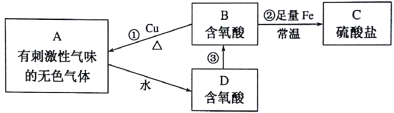
请按要求回答下列问题:
(1)A的化学式为_______。
(2)反应①、②中Cu、Fe所起的作用相同,即都作_______(填“氧化剂”或“还原剂”),你判断的依据是它们都是金属,在反应中都_______。
(3)反应②的离子方程式为_______。
(4)大气中因废气A引起酸雨的反应流程之一可用下图示意:
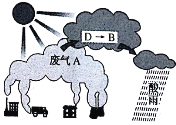
上图中由D→B的转化所需氧化剂为_______。
当将含D的雨水敞口放置一段时间后(忽略溶液体积、温度的变化),其c(H+)将_______。(填“增大”“减小”或“不变”)。废气A是一种重要的化工原料,常采用氨吸收法进行循环利用、变废为宝。某工厂若将4.48×106L(标准状况下)废气A进行环保处理,完全转化为 NH4HSO3时,需消耗10mol/L氨水溶液(溶质全部以NH3H2O计)的体积为_______L。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了测定某有机物A的结构,做如下实验:
①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和2.7 g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1∶2∶3。试回答下列问题:
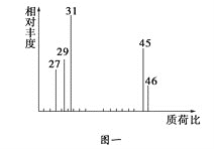

(1)有机物A的相对分子质量是________。
(2)有机物A的实验式是________。
(3)A的分子式是_______________________________________。
(4)A的结构简式为___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
请按要求回答下列问题:
(1)元素①与⑨组成的化合物的电子式:_______;元素②的原子结构示意图_______。
(2)对比相同条件下元素⑥、⑦的单质分别与水反应的剧烈程度,可得到的结论:同一周期元素,随核电荷数的增加,_______;写出元素⑥的单质与水反应的化学方程式_______。
(3)能说明元素⑤的非金属性强于元素⑨的依据是_______。
(4)元素①与②所形成的最简单有机物的结构式是_______。元素①与②所形成的最简单烯烃为M,写出M与元素①的单质在一定条件下反应的化学方程式:_______,该反应类型为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。

已知:![]() +H2O
+H2O

(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_______,导管B除了导气外还具有的作用是_______________________。
②试管C置于冰水浴中的目的是_______________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层(填“上”或“下”),分液后用__________(填编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_____口进入(填“f”或“g”)。蒸馏时要加入生石灰,目的是____________________________________。

③收集产品时,控制的温度应在_______左右,实验制得的环己烯精品质量低于理论产量,可能的原因是____________(填字母序号,下同)。
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是____________。
a.用酸性高锰酸钾溶液
b.用金属钠
c.测定沸点
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4L N2所含原子的数目为NA
B.1mol/L的CaCl2溶液中含Cl的数目为2NA
C.2.4gMg与足量盐酸完全反应时,失去电子的数目为0.2NA
D.常温常压下,48g O3和O2的混合气体中,含有分子的数目为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,将溴水分别加入到盛有同浓度、同体积的NaCl溶液、KI溶液的试管中,用力振荡后加入少量CCl4,振荡、静置,观察现象。下列说法正确的是
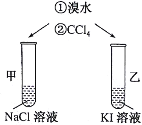
A.甲试管中上层溶液呈黄色
B.乙试管中下层溶液呈紫色
C.甲试管中实验现象可说明Br2的氧化性强于Cl2
D.乙试管中反应的离子方程式为Br2+I-=I2+Br-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关Na2CO3和 NaHCO3的叙述正确的是
A.常温下,Na2CO3的溶解度比 NaHCO3小
B.Na2CO3溶液显碱性, NaHCO3溶液显酸性
C.可用加热的方法除去 NaHCO3中混有的Na2CO3杂质
D.与足量盐酸反应得到等量的CO2时,消耗 NaHCO3的质量比Na2CO3少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com