
科目: 来源: 题型:
【题目】(1)有机物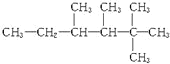 用系统命名法命名_________
用系统命名法命名_________
(2)若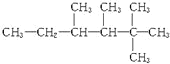 是某单烯烃与氢气加成后的产物,则该烯烃可能有___________种结构;若是某炔烃与氢气加成后的产物,则此炔烃可能有___________种结构。
是某单烯烃与氢气加成后的产物,则该烯烃可能有___________种结构;若是某炔烃与氢气加成后的产物,则此炔烃可能有___________种结构。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,在HA和NaA的混合溶液中 c(HA)+c(A-)=0.1 mol·L-1,溶液中c(HA) 和c(A-)的大小随着pH变化的关系如图所示。下列有关叙述不正确的是
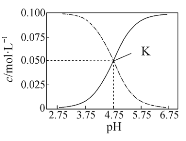
A.常温下,HA的电离平衡常数约为10-5
B.在pH=3.75溶液中:c(Na+)+c(H+)+c(HA) = c(OH-) +0.1 mol·L-1
C.在pH=5.75溶液中:c(OH-)<c(H+)<c(A-)<c(HA)
D.在K点的溶液中,HA的电离程度大于A-的水解程度
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醛是制备乙酸、乙酸衍生物等化工产品的原料。完成下列填空:
(1)乙醛分子中的官能团为______。
(2)将铜丝在空气中灼烧变黑后,迅速伸入乙醇中,观察到铜丝表面______;反复上述多次操作后,闻到刺激性气味,说明有______生成。
(3)写出检验乙醛的化学反应方程式。______上述反应显示乙醛具有______性。
(4)已知甲酸也能发生银镜反应,若某甲酸溶液中可能混有乙醛,如何通过实验证明是否含有乙醛并写出简要操作步骤________________
(5)已知:有机化学中将紧邻官能团的第一个碳原子成为α—C,α—C上的H就称为α—H,醛的α—H较活泼,可以和另一个醛的羰基进行加成,生成羟基醛,如:
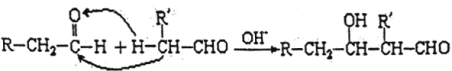
设计一条以乙烯为原料制备正丁醇CH3CH2CH2CH2OH的合成路线(无机试剂任选):_________(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
编号 | 实验I | 实验II | 实验III |
实验步骤 |
| 将实验I褪色后的溶液分三份分别进行实验
| 为进一步探究“红色褪去”的原因,又进行以下实验 ① ②取反应后的溶液,滴加盐酸和BaCl2溶液 |
现象 | 溶液先变红,片刻后红色褪去,有气体生成(经检验为O2) | ①无明显现象 ②溶液变红 ③产生白色沉淀 | ①溶液变红,一段时间后不褪色。 ②无白色沉淀产生 |
分析上述三个实验,下列叙述不正确的是
A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关
查看答案和解析>>
科目: 来源: 题型:
【题目】国际能源期刊报道了一种正在开发中的绿色环保“全氢电池”,有望减少废旧电池产生污染。其工作原理如图所示。下列说法正确的是
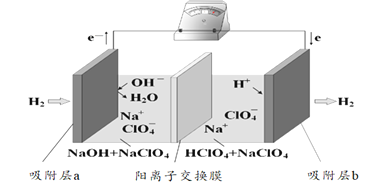
A.“全氢电池”工作时,将酸碱反应的中和能转化为电能
B.吸附层b发生的电极反应:H2 – 2e- + 2 OH-= 2H2O
C.Na+ 在装置中从右侧透过阳离子交换膜向左侧移动
D.“全氢电池”的总反应: 2H2 + O2 =2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学进行硫酸铜晶体(![]() )结晶水含量的测定实验。完成下列填空:
)结晶水含量的测定实验。完成下列填空:
(实验步骤):
(1)在__________(填仪器名称)准确称量瓷坩埚的质量。
(2)在瓷坩埚中加入一定量的硫酸铜晶体,并称重。
(3)把盛有硫酸铜晶体的瓷坩埚放在泥三角上慢慢加热,直到蓝色完全变白,然后把坩埚移至_______(填仪器名称)中冷却到室温,并称重。
(4)重复上述实验进行恒重操作,其目的是_______________,直到两次称量结果不超过______克。
(5)下面是该学生实验的一次数据,请完成计算:
坩埚质量(克) | 坩埚与晶体的质量(克) | 恒重后坩埚与固体质量 |
13.721 | 24.692 | 20.631 |
![]() ______;(精确到0.01)实验相对误差是_________(保留小数后一位)。
______;(精确到0.01)实验相对误差是_________(保留小数后一位)。
(6)这次实验中产生误差的原因可能是_______
a. 硫酸铜晶体中含有不挥发性杂质 b. 在加热过程中发现有黑色物质生成
c. 加热时有晶体飞溅出来 d. 加热失水后露置在空气中冷却
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分。请按要求填空:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
1 | ||||||||
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表列①~⑨号元素中,原子半径最大的是________(填数字序号);非金属性最强的元素是________(填数字序号);最高价氧化物对应的水化物中酸性最强的是_______(填数字序号);化学性质最稳定的是________(填数字序号)。
(2)元素③的常见氢化物的电式为_________,此氢化物与元素⑨的氢化物化合后溶于水,水溶液中离子浓度由大到小的顺序是________(用离子符号表示)。
(3)将元素⑦的单质用砂纸打磨后,滴上几滴![]() 溶液片刻后表面会形成白色毛状物,该毛状物的化学式是______________。将元素⑦的单质的粉末与铁红混合在高温下反应会放出大量热,写出该反应的化学方程式____________
溶液片刻后表面会形成白色毛状物,该毛状物的化学式是______________。将元素⑦的单质的粉末与铁红混合在高温下反应会放出大量热,写出该反应的化学方程式____________
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是指导化学学习的重要工具。下图为元素周期表的一部分。请按要求填空:
N | O | F | |||||
Mg | Al | S | Cl | ||||
(1)N元素形成的单质的电子式_________;N元素的气态氢化物含有化学键属于_______(“离子键”或“共价键”)。
(2)Mg和Al中,金属性较强的是_______(写元素符号),写出一条能说明该结论的事实(用文字描述)___________
(3)S和Cl中,非金属性较强的是___________(写元素符号),不能说明该结论的事实是________(填字母符号)。
a. 单质硫难溶于水,氯气能溶于水
b. ![]() 通入
通入![]() 溶液中,溶液变浑浊
溶液中,溶液变浑浊
c. 受热时![]() 易分解,HCl不易分解
易分解,HCl不易分解
d. 氯气与铁反应生成![]() ,硫与铁反应生成FeS
,硫与铁反应生成FeS
(4)O和S中,非金属性较强的是_________(写元素符号),写出能说明该结论的化学方程式______________
查看答案和解析>>
科目: 来源: 题型:
【题目】温度分别为T1和T2时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
温度/K | t/min | t1 | t2 | t3 | t4 |
T1 | n(Y)/mol | 0.14 | 0.12 | 0.10 | 0.10 |
T2 | n(Y)/mol | 0.13 | 0.09 | 0.08 |
下列说法正确的是( )
A. 该反应的正反应为放热反应
B. T2温度下此反应的平衡常数K=4
C. 温度为T1时,0~t1时间段的平均速率υ(Z)=2.0×10-3mol·L-1·min-1
D. 在T1下平衡后,保持其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com