
科目: 来源: 题型:
【题目】以环己醇为原料制取己二酸[HOOC(CH2)4COO H]的实验流程如下:
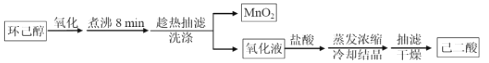
其中“氧化”的实验过程:在250mL四颈烧瓶中加入50 mL水和3.18g碳酸钠,低速搅拌至碳酸钠溶解,缓慢加入9.48g(约0.060 mol)高锰酸钾,按图示搭好装置:
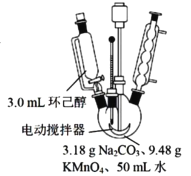
打开电动搅拌,加热至35℃,滴加3.2 mL(约 0.031 mol) 环己醇,发生的主要反应为:![]()
![]() KOOC(CH2)4COOK H<0
KOOC(CH2)4COOK H<0
(1)“氧化”过程应采用____________加热
(2)“氧化”过程为保证产品纯度需要控制环己醇滴速的原因是:_______________。
(3)为证明“氧化”反应已结束,在滤纸上点1滴混合物,若观察到___________则表明反应已经完成。
(4)“趁热抽滤”后,用___________进行洗涤(填“热水”或“冷水")。
(5)室温下,相关物质溶解度如表:
化学式 | 己二酸 | NaCl | KCl |
溶解度g/100g水 | 1.44 | 35.1 | 33.3 |
“蒸发浓缩”过程中,为保证产品纯度及产量,应浓缩溶液体积至_________(填标号)
A.5mL B.10mL C.15mL D.20mL
(6)称取己二酸(Mr-=146 g/mol)样品0.2920 g,用新煮沸的50 mL 热水溶解,滴入2滴酚酞试液,用0.2000 mol/L NaOH 溶液滴定至终点,消耗 NaOH 的平均体积为 19.70 mL。NaOH 溶液应装于____________(填仪器名称),己二酸样品的纯度为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯酚是一种重要的化工原料。以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N.(部分产物及反应条件已略去)

(1)B的官能团的名称是_______________。
(2)已知C的分子式为C5H12O,C能与金属Na反应,C的核磁共振氢谱有3组峰,则C的结构简式 ______________________。
(3)由D生成N的反应类型是_________,B与C反应生成M的反应类型是_________。
(4)写出M与NaOH溶液反应的化学方程式是__________________________________。
(5)物质F的结构是: ,则符合下列条件的F的同分异构体有 ______种。
,则符合下列条件的F的同分异构体有 ______种。
①能发生银镜反应 ②能与NaHCO3溶液反应 ③分子中有苯环,无 结构。其中苯环上只有两个取代基,且核磁共振氢谱有4组峰,峰面积之比为1:2:2:1的为___________(写结构简式)。
结构。其中苯环上只有两个取代基,且核磁共振氢谱有4组峰,峰面积之比为1:2:2:1的为___________(写结构简式)。
(6)已知: ,写出以苯酚、乙醇和ClCH2COOH为原料制备
,写出以苯酚、乙醇和ClCH2COOH为原料制备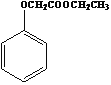 的合成路线流程图(无机试剂任用)。___________
的合成路线流程图(无机试剂任用)。___________
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钛因为其优越的性能被称为“未来金属”,其工业冶炼涉及到的反应如下:TiO2+2C+2Cl2 TiCl4+2CO。回答下列相关问题:
TiCl4+2CO。回答下列相关问题:
(1)基态钛原子的价层电子排布式为____ ,上述反应中非金属元素电负性由大到小是______;
(2)已知部分物质熔沸点如下:
名称 | 金红石 | 金刚石 | 四氯化钛 | 四溴化钛 | 四碘化钛 |
化学式 | TiO2 | C | TiCl4 | TiBr4 | TiI4 |
熔点/℃ | 1830 | 3550 | -24.1 | 38 | 150 |
沸点/℃ | 2927 | 4827 | 136.4 | 233.1 | 377.2 |
自左向右,表中的三种钛的卤化物熔沸点依次升高的原因是__________。
(3)配位数为6,组成为TiCl36H2O 的晶体有两种:化学式为[TiCl(H2O)5]Cl2H2O的X呈绿色,定量实验表明,X与AgNO3以1:2物质的量比反应生成沉淀。Y呈紫色,且Y与AgNO3 以1:3物质的量之比反应生成沉淀,则Y的化学式为 ______。
(4)钙钛矿是重要的含钛矿物之一。其主要成分Z 的晶胞如图所示。推测Z的化学式为__________,Ca填充在O围成的_________空隙中。

(5)若晶胞参数 a=384.1pm,Z晶体的密度为 _________列出计算表达式并计算出两位有效数字结果,3.8413≈56.67,阿伏加德罗常数用 6.0×1023 mol-1)
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )
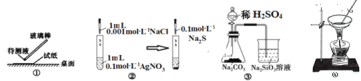
A.①用pH试纸测某溶液的酸碱性
B.实验室用图②所示装置若先出现白色沉淀后又变黑,则能比较Ksp(AgCl)﹥Ksp(Ag2S)
C.实验室用图③所示装置证明酸性:H2SO4>H2CO3>H2SiO3
D.图④可由AlCl3饱和溶液制备AlCl3晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2的回收与利用是科学家研究的热点课题。可利用CH4与CO2制备合成气(CO、H2),还可制备甲醇、二甲醚、低碳烯经等燃料产品。
I.科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)C(ads) +2H2(g) (慢反应)
反应②:C(ads) + CO2(g)2CO(g) (快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
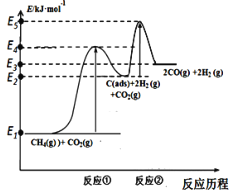
(1)CH4与CO2制备合成气的热化学方程式为____________:该反应在高温下可自发正向进行的原因是_________,能量变化图中:E5+E1___E4+E2(填“>”、“<”或“=”)。
II.利用“合成气”合成申醇后,脱水制得二甲醚。
反应为:2CH3OH(g)CH3OCH3 (g) + H2O(g) △H
经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度存在如下关系:lnKc=-2.205+![]() 。其速率方程为:v正=k正c2(CH3OH),v逆=k逆c(CH3OCH3)c(H2O),k正、K逆为速率常数,且影响外因只有温度。
。其速率方程为:v正=k正c2(CH3OH),v逆=k逆c(CH3OCH3)c(H2O),k正、K逆为速率常数,且影响外因只有温度。
(2)反应达到平衡后,仅升高温度,k正增大的倍数________ k逆增大的倍数(填“>”、“<”或“= ”)。
(3)某温度下,Kc=200,在密闭容器中加入一定量CH3OH。反应到某时刻测得各组分的物质的量如下:
物质 | CH3OH | CH3OCH3 | H2O |
物质的量/mol | 0.4 | 0.4 | 0.4 |
此时正、逆反应速率的大小:v正 ____v逆(填“>”、“<”或“=”)。
(4)500K下,在密闭容器中加入一定量甲醇CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为_____(埴标号)
A.![]() B.
B.![]() C.
C.![]() D.无法确定
D.无法确定
Ⅲ.合成低碳烯经
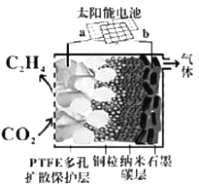
(5)强碱性电催化还原CO2制备乙烯研究取得突破进展,原理如图所示。b极接的是太阳能电池的_______极(已知PTFE浸泡了饱和KCl溶液)。请写出阴极的电极反应式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】向某Na2CO3、NaHCO3的混合溶液中加入少量的BaCl2,测得溶液中![]() 与
与![]() 的关系如图所示,下列说法正确的是
的关系如图所示,下列说法正确的是
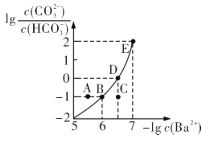
A.该溶液中![]()
B.B、D、E三点对应溶液pH的大小顺序为B>D>E
C.A、B、C三点对应的分散系中,A点的稳定性最差
D.D点对应的溶液中一定存在2c(Ba2+ ) +c(Na+ )+c(H+ )=c(CO32- )+c(OH- )+c(Cl- )
查看答案和解析>>
科目: 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
2NH3(g) ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
A. 容器内的温度不再变化
B. 容器内的压强不再变化
C. 相同时间内,断开H-H键的数目和生成N-H键的数目相等
D. 容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大 气相通,B区为封闭体系并有N2保护。下列关于该电池的说法错误的是( )
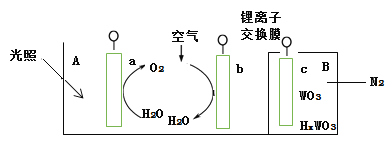
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3 - xe- =WO3 + xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c, b电极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关叙述正确的是( )

A. 如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯
B. 若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL 0.50 mol·L-1的硫酸充分反应,两反应测定的中和热不相等
C. 为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替
D. 中和热测定实验也可以用稀硫酸与氢氧化钠溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )

A. 每生成2 mol AB吸收bkJ热量
B. 该反应热△H= + (a-b)kJ mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出akJ能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com