
【题目】用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )
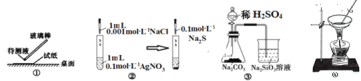
A.①用pH试纸测某溶液的酸碱性
B.实验室用图②所示装置若先出现白色沉淀后又变黑,则能比较Ksp(AgCl)﹥Ksp(Ag2S)
C.实验室用图③所示装置证明酸性:H2SO4>H2CO3>H2SiO3
D.图④可由AlCl3饱和溶液制备AlCl3晶体
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
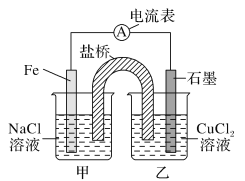
(1)如图为某实验小组依据的氧化还原反应:(用离子方程式表示)______设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为:_________,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因_____。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示:
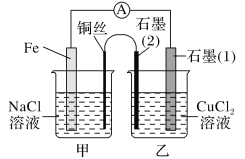
一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是_____,电极反应为______________;乙装置中与铜丝相连石墨(2)电极上发生的反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环已醇被高锰酸钾“氧化”发生的主要反应为![]() KOOC(CH2)4COOK ΔH<0,(高锰酸钾还原产物为MnO2)实验过程:在四口烧瓶装好药品,打开电动搅拌,加热,滴加环己醇,装置如图。 下列说法不正确的是
KOOC(CH2)4COOK ΔH<0,(高锰酸钾还原产物为MnO2)实验过程:在四口烧瓶装好药品,打开电动搅拌,加热,滴加环己醇,装置如图。 下列说法不正确的是
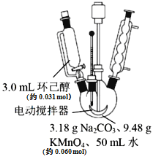
A.“氧化”过程应采用热水浴加热
B.装置中用到的球形冷凝管也可以用于蒸馏分离实验
C.滴加环己醇时不需要打开恒压滴液漏斗上端活塞
D.在滤纸上点1滴反应后混合物,未出现紫红色,则反应已经完成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年2月15日,由国家科研攻关组的主要成员单位的专家组共同研判磷酸氯喹在细胞水平上能
有效抑制新型冠状病毒(2019-nCoV)的感染。
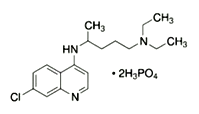
(1)已知磷酸氯喹的结构如图所示,则所含C、N、O三种元素第一电离能由大到小的顺序为_______________。P原子核外价层电子排布式为________,其核外电子有____个空间运动状态。
(2)磷酸氯喹中N原子的杂化方式为_________,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是_______________________。
(3)H3PO4中PO43- 的空间构型为________________。
(4)磷化镓是一种由ⅢA族元素镓(Ga)与VA族元素磷(P)人工合成的Ⅲ—V族化合物半导体材料。晶胞结构可看作金刚石晶胞内部的碳原子被P原子代替,顶点和面心的碳原子被Ga原子代替。
①磷化镓晶体中含有的化学键类型为__________(填选项字母)
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如图,则原子2的分数坐标为______________。

③若磷化镓的晶体密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置,在试管A里加入3mL乙醇和2mL冰醋酸,然后一边摇动,一边慢慢地加入2mL浓硫酸,再加入少量碎瓷片,用酒精灯加热10min,结果在饱和碳酸钠溶液的液面上没有无色油状液体,下列对其原因的分析错误的是( )
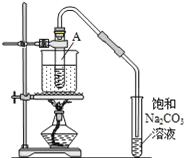
A.试管A中没有发生反应
B.热源小、水量多,水浴升温速度太慢
C.产物蒸汽在试管A上部全部被冷凝回流
D.产物已全部溶解在饱和Na2CO3溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物在工业上有着广泛的应用。完成下列填空:
(1)写出工业上以硫磺为原料生产硫酸的第一步反应方程式______
(2)工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,主要反应如下:____Mn2++____S2O82﹣+____H2O→____MnO4﹣+____SO42﹣+______H+。配平该反应方程式,氧化产物是______
(3)用电解硫酸氢钾的方法制取过硫酸钾:HSO4﹣在______(填:“阳极”或“阴极”)反应生成S2O82﹣,另一极生成氢气,生成0.1mol的S2O82﹣同时可收集到______g氢气
(4)已知硫酸的第二级电离并不完全:HSO4﹣![]() H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是____,第4位的离子是____。往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中
H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是____,第4位的离子是____。往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中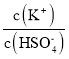 ____(填:“增大”、“减小”或“不变”)
____(填:“增大”、“减小”或“不变”)
(5)已知:HSO3﹣H++SO32﹣K=1.02×10﹣7,NH4++H2ONH3H2O+H+ K=5.65×10﹣10。往亚硫酸氢铵中加入一定量的氢氧化钡溶液,可能发生的反应离子方程式是____(选填编号)
a.HSO3﹣+Ba2++OH﹣=BaSO3↓+H2O
b.NH4++2HSO3﹣+2Ba2++3OH﹣=2BaSO3↓+2H2O+NH3H2O
c.NH4++HSO3﹣+Ba2++2OH﹣=BaSO3↓+H2O+NH3H2O
d.2NH4++4HSO3﹣+3Ba2++6OH﹣=3BaSO3↓+4H2O+2NH3H2O+SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异戊酸薄荷酯(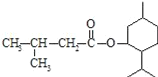 )是一种治疗心脏病的药物,可由甲基丙烯、丙烯和
)是一种治疗心脏病的药物,可由甲基丙烯、丙烯和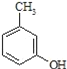 为原料制取。完成下列填空:
为原料制取。完成下列填空:
(1)制取异戊酸薄荷酯的最后一步为酯化反应,其反应物的结构简式为:______
(2) 的名称______,其属于芳香族化合物的同分异构有___种(不含
的名称______,其属于芳香族化合物的同分异构有___种(不含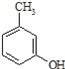 )
)
(3)制取异戊酸薄荷酯的流程中,有一步反应为: +CH3﹣CH=CH2
+CH3﹣CH=CH2![]()
 反应类型属于______反应。有机反应中通常副反应较多,实际生产中发现生成
反应类型属于______反应。有机反应中通常副反应较多,实际生产中发现生成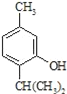 的量远大于生成
的量远大于生成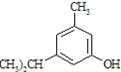 的量,试分析其原因:______
的量,试分析其原因:______
(4)甲基丙烯是重要的化工原料,请设计一条由苯和甲基丙烯通过三步反应制取化工中间体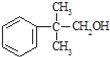 的合成线路______
的合成线路______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生反应:2HI(g)![]() H2(g)+I2(g),0~15 s内c(HI)由0.1 mol/L降到0.07 mol/L,则下列说法正确的是 ( )
H2(g)+I2(g),0~15 s内c(HI)由0.1 mol/L降到0.07 mol/L,则下列说法正确的是 ( )
A. 当HI、H2、I2浓度之比为2∶1∶1时,说明该反应达平衡
B. c(HI)由0.07 mol/L降到0.05 mol/L所需的反应时间小于10 s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 0~15s内用I2表示的平均反应速率为:v(I2)=0.001 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法正确的是( )

A.a点时溶液中阳离子仅为Cu2+和Fe2+
B.b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C.c点时加入的铁粉与Cu2+反应
D.原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com