
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
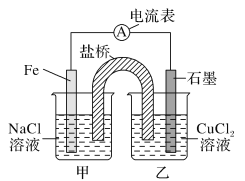
(1)如图为某实验小组依据的氧化还原反应:(用离子方程式表示)______设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为:_________,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因_____。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示:
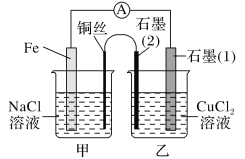
一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是_____,电极反应为______________;乙装置中与铜丝相连石墨(2)电极上发生的反应式为_______________________。
【答案】Fe+Cu2+=Fe2++Cu 0.2 2H++2e-=H2↑ 酸性 NH4++H2O![]() NH3·H2O+H+ 溶液变红 O2+2H2O+4e-=4OH- 2Cl--2e-=Cl2↑
NH3·H2O+H+ 溶液变红 O2+2H2O+4e-=4OH- 2Cl--2e-=Cl2↑
【解析】
(1)由装置图可知,该装置为双液原电池,其中Fe作负极,失去电子,发生氧化反应,电解质溶液中Cu2+得到电子,发生还原反应,由此可书写离子方程式;一段时间后,两电极质量相差12 g,根据差量法进行计算;
(2) 将CuCl2溶液换为NH4Cl溶液,溶液呈酸性,石墨电极为正极,正极上H+得到电子生成H2;
(3) 若将盐桥换成弯铜导线与石墨相连成n型,甲装置为铁的吸氧腐蚀,乙装置为电解池。
(1)由装置图可知,该装置为双液原电池,其中Fe作负极,失去电子,发生氧化反应,电解质溶液中Cu2+得到电子,发生还原反应,离子方程式为:Fe+Cu2+=Fe2++Cu;一段时间后,两电极质量相差12 g,根据差量法可设电子转移了xmol,那么有:
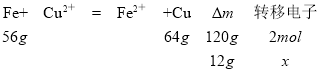
![]() =
=![]() ,解得x=0.2mol,即一段时间后,两电极质量相差12 g,导线中通过0.2mol电子;
,解得x=0.2mol,即一段时间后,两电极质量相差12 g,导线中通过0.2mol电子;
(2) 将CuCl2溶液换为NH4Cl溶液,由于NH4+水解而使溶液显酸性,水解反应的离子方程式为:NH4++H2O![]() NH3·H2O+H+;石墨作正极,电极反应为:2H++2e-=H2↑;
NH3·H2O+H+;石墨作正极,电极反应为:2H++2e-=H2↑;
(3) 若将盐桥换成弯铜导线与石墨相连成n型,甲装置为铁的吸氧腐蚀,其中铁作负极,铜作正极,正极的电极反应为:O2+2H2O+4e-=4OH-,溶液中c(OH-)增大,碱性增强,滴加酚酞后,溶液变为红色;乙装置中,与铜相连的石墨(2)为阳极,与铁相连的石墨(1)为阴极,其中与铜丝相连石墨(2)电极上发生的反应式为2Cl--2e-=Cl2↑。
原电池 | 电解池 | |
定义 | 将化学能转变成电能的装置 | 将电能转变成化学能的装置 |
形成条件 | ①活泼性不同的两电极(连接) ②电解质溶液(电极插入其中并与电解质溶液或其中溶解的其他物质自发反应) ③形成闭合回路 ④自发的氧化还原反应 | ①两电极分别接直流电源的正、负极 ②两电极插入电解质溶液 ③形成闭合回路 |
电极名称 | 负极:较活泼金属 正极:较不活泼金属(或能导电的非金属) | 阳极:与电源正极相连的极 阴极:与电源负极相连的极 |
电极反应 | 负极:金属失电子,发生氧化反应 正极:溶液中的阳离子得电子,发生还原反应 | 阳极:氧化反应、溶液中的阴离子失电子或电极金属失电子 阴极:还原反应,溶液中的阳离子得电子 |
电子流向 | 负极 | 电源负极 电源正极 |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】已知某弱酸的酸式盐有NaH2XO4和Na2HXO4两种,其中NaH2XO4的溶液呈酸性,Na2HXO4溶液呈碱性。30℃时,NaH2XO4溶液和Na2HXO4溶液,二种溶液的浓度均为0.1mol·L-1,其中均存在的关系是( )
A.c(H+)·c(OH-)=1×10-14
B.c(H+)+2c(H3XO4)+c(H2XO4-)=c(XO43-)+c(OH-)
C.c(Na+)+c(H+)=c(H2XO4-)+c(OH-)+2c(HXO42-)+3c(XO43-)
D.c(H+)+c(H3XO4)=c(HXO42-)+2c(XO43-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,恒容密闭容器中,可逆反应H2(g)+I2(g)![]() 2HI(g)达到化学平衡状态的标志是
2HI(g)达到化学平衡状态的标志是
A.混合气体的压强不再变化B.混合气体的颜色不再变化
C.反应速率v(H2)=0.5v (HI)D.c(H2):c(I2):c(HI)=1:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,可以用作新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过。下列说法不正确的是

A. 放电时,负极反应式:Li-e- =Li+
B. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗标准状况下11.2 L O2
C. 放电时,随外电路中电子的转移,水性电解液中离子总数减少
D. Li+穿过固体电解质向正极移动而得到LiOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表记录了t℃时的4份相同的硫酸铜溶液中加入无水硫酸铜的质量以及析出的硫酸 铜晶体(CuSO4·5H2O)的质量(温度保持不变)的实验数椐:
硫酸铜溶液 | ① | ② | ③ | ④ |
加入的无水硫酸铜(g) | 3.00 | 5.50 | 8.50 | 10.00 |
析出的硫酸铜晶体(g) | 1.00 | 5.50 | 10.90 | 13.60 |
当加入6.20g无水硫酸铜时,析出硫酸铜晶体的质量(g)为
A.7.70B.6.76C.5.85D.9.00
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PLLA塑料不仅具有良好的机械性能,还具有良好的可降解性。它可由石油裂解气为原料合成。下列框图是以石油裂解气为原料来合成PLLA塑料的流程图(图中有部分产物及反应条件未列出)。

请回答下列问题:
(1)属于取代反应的有______________(填编号)。
(2)写出下列反应的化学方程式:
反应③:________________________________;
反应⑤:______________________________。
(3)已知E(C3H6O3)存在三种常见不同类别物质的异构体,请各举一例(E除外)并写出其结构简式:______________________、__________________、_______________。
(4)请写出一定条件下PLLA废弃塑料降解的化学方程式___________________________。
(5)已知:![]() ,炔烃也有类似的性质,设计丙烯合成
,炔烃也有类似的性质,设计丙烯合成![]() 的合成路线_______
的合成路线_______
(合成路线常用的表示方法为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炔烃的偶联反应在开发新型发光材料、超分子等领域有重要研究价值。乙炔发生的偶联反应为 2CH≡CH ![]() CH≡CC≡CH+H2。乙炔偶联反应过程中能量变化如图甲中曲线Ⅰ所示,曲线Ⅱ为改变某一条件的能量变化。下列说法不正确的是( )
CH≡CC≡CH+H2。乙炔偶联反应过程中能量变化如图甲中曲线Ⅰ所示,曲线Ⅱ为改变某一条件的能量变化。下列说法不正确的是( )
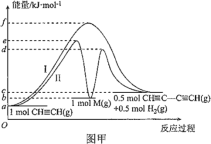
A.曲线Ⅰ,反应物的总键能大于生成物的总键能
B.曲线Ⅱ改变的条件是加入了催化剂
C.曲线Ⅱ对应条件下,第一步反应的 ΔH=+(b-a)kJ·mol-1
D.曲线Ⅱ对应条件下,决定总反应速率的大小是第二步反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】称取10g含杂质的Na2CO3样品(杂质不参与反应),加入100 mL(设密度为1.0g·mL-1)稀盐酸,充分反应后烧杯中剩余物质的总质量为106.48g(生成的气体全部逸出),碳酸钠样品的纯度为 _______________________。若将反应后的溶液加水稀释到400mL,测得溶液的pH为1,则原稀盐酸的物质的量浓度为 _________________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )
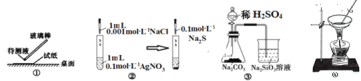
A.①用pH试纸测某溶液的酸碱性
B.实验室用图②所示装置若先出现白色沉淀后又变黑,则能比较Ksp(AgCl)﹥Ksp(Ag2S)
C.实验室用图③所示装置证明酸性:H2SO4>H2CO3>H2SiO3
D.图④可由AlCl3饱和溶液制备AlCl3晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com