
【题目】一定温度下,恒容密闭容器中,可逆反应H2(g)+I2(g)![]() 2HI(g)达到化学平衡状态的标志是
2HI(g)达到化学平衡状态的标志是
A.混合气体的压强不再变化B.混合气体的颜色不再变化
C.反应速率v(H2)=0.5v (HI)D.c(H2):c(I2):c(HI)=1:1:2
【答案】B
【解析】
可逆反应达到平衡状态时,正反应速率等于逆反应速率,各物质的浓度、物质的量等不再发生变化,据此分析判断。
A.该反应为等体积反应,当混合气体的压强不再变化时,不能证明反应达到了平衡状态,A项错误;
B.当混合气体的颜色不再变化时,即碘蒸气的浓度不再变化,证明可逆反应达到了平衡状态,B项正确;
C.在任意时刻时都有速率之比等于化学计量数之比,因此当反应速率v(H2)=0.5v (HI)时不能证明达到平衡状态,C项错误;
D.达到平衡时各物质的浓度不再发生变化,因此当c(H2):c(I2):c(HI)=1:1:2时不能证明达到了平衡状态,D项错误;
答案选B。
化学反应 | mA(g)+nB(g) | 是否平衡 |
正、逆反 应速率之 间的关系 | ①单位时间内消耗了m mol A,同时也生成了m mol A | 平衡 |
②单位时间内消耗了n mol B,同时也消耗了p mol C | 平衡 | |
③v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q | 不一定平衡 | |
④单位时间内生成了n mol B,同时也消耗了q mol D | 不一定平衡 | |
混合气体的平均相对分子质量 | ①平均相对分子质量一定,且m+n≠p+q | 平衡 |
②平均相对分子质量一定,且m+n=p+q | 不一定平衡 | |
气体密度(ρ) | ①只有气体参加的反应,密度保持不变(恒容密闭容器中) | 不一定平衡 |
②m+n≠p+q时,密度保持不变(恒压容器中) | 平衡 | |
③m+n=p+q时,密度保持不变(恒压容器中) | 不一定平衡 |


科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是
A.离子结构示意图:![]() 可以表示16O2-,也可以表示18O2-
可以表示16O2-,也可以表示18O2-
B.比例模型:![]() 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子
C.氯化铵的电子式为:![]()
D.二氧化碳分子的比例模型是: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1(N2的键能为942kJ·mol-1),晶体片段结构如右图所示。又发现利用N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是( )
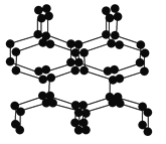
A. 按键型分类,该晶体中含有非极性共价键
B. 含N5+离子的化合物中既有离子键又有共价键
C. 高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D. 这种固体的可能潜在应用是烈性炸药或高能材料
查看答案和解析>>
科目:高中化学 来源: 题型:
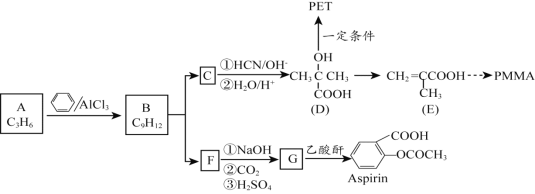
【题目】有机材料PMMA、新型可降解高分子材料PET、常见解热镇痛药Aspirin的合成路线如下:
已知:![]()
![]()
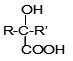
(1)A属于烯烃,其结构简式是_______。
(2)A与苯在AlCl3催化作用下反应生成B的反应类型是_______。
(3)写出B的一溴代物只有2种的芳香烃的名称__________写出生成这两种一溴代物所需要的反应试剂和反应条件____________
(4)B在硫酸催化条件下被氧气氧化可得有机物C与F。
①C由碳、氢、氧三种元素组成, C的结构简式是_________。
②向少量F溶液中滴加几滴FeCl3溶液,溶液呈紫色,且F在其同系物中相对分子质量最小。G物质中含氧官能团名称为_______。
(5)D在一定条件下制取PET的化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电化学技术作为一种新型水处理工艺,因具有污染物同步去除和能源化的特点而受到广泛关注。一种典型的乙酸降解微生物电化学系统(MES)工作原理如下图所示。下列说法错误的是
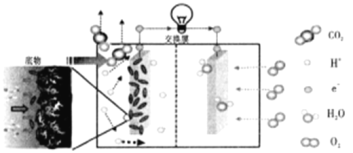
A.MES系统中的交换膜为阳离子交换膜
B.乙酸降解过程中,若电路中流过2 mol电子,则理论上右室需要通入O2约11.2L
C.通入O2的一极为正极,发生还原反应
D.逸出CO2的一侧电极反应式为CH3COOH-8e-+2H2O=2CO2↑+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氨(NH2OH)是一种还原剂,和联氨一样是一种弱碱,不稳定,室温下吸收水汽迅速分解。回答下列问题:
(1)请写出羟氨的电子式___。
(2)利用KMnO4标准溶液定量间接测定羟氨的纯度。测定步骤如下:
①溶液配制:称取5.0g某羟氨样品,溶解在______酸中后加适量蒸馏水,将其全部转移至100mL的______中,加蒸馏水至_______。
②取20.00mL的羟氨酸性溶液与足量硫酸铁在煮沸条件下反应:2NH2OH2++4Fe3+=N2O↑+4Fe2++H2O+6H+,生成的Fe2+用0.4000 mol·L-1的酸性KMnO4溶液滴定,滴定达到终点的现象是____________。请写出Fe2+与酸性KMnO4溶液反应的离子方程式_____________。重复滴定3次,每次消耗酸性高锰酸钾标准溶液的体积如表所示:
![]()
计算试样的纯度____%。
(3)下列操作导致误差偏高的有______(填编号)。
a 滴定前滴定管尖嘴处有气泡,滴定后消失
b 滴定管未经润洗盛装KMnO4溶液
c 羟氨称量时,时间过长和溶解时没有及时用酸酸化
d KMnO4溶液起始读数仰视,终点正常读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
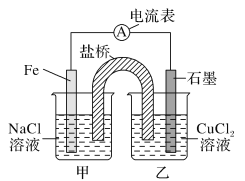
(1)如图为某实验小组依据的氧化还原反应:(用离子方程式表示)______设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为:_________,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因_____。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示:
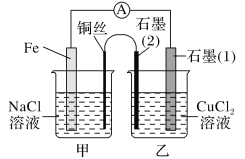
一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是_____,电极反应为______________;乙装置中与铜丝相连石墨(2)电极上发生的反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环已醇被高锰酸钾“氧化”发生的主要反应为![]() KOOC(CH2)4COOK ΔH<0,(高锰酸钾还原产物为MnO2)实验过程:在四口烧瓶装好药品,打开电动搅拌,加热,滴加环己醇,装置如图。 下列说法不正确的是
KOOC(CH2)4COOK ΔH<0,(高锰酸钾还原产物为MnO2)实验过程:在四口烧瓶装好药品,打开电动搅拌,加热,滴加环己醇,装置如图。 下列说法不正确的是
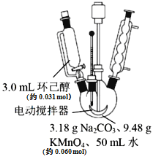
A.“氧化”过程应采用热水浴加热
B.装置中用到的球形冷凝管也可以用于蒸馏分离实验
C.滴加环己醇时不需要打开恒压滴液漏斗上端活塞
D.在滤纸上点1滴反应后混合物,未出现紫红色,则反应已经完成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com