
【题目】羟氨(NH2OH)是一种还原剂,和联氨一样是一种弱碱,不稳定,室温下吸收水汽迅速分解。回答下列问题:
(1)请写出羟氨的电子式___。
(2)利用KMnO4标准溶液定量间接测定羟氨的纯度。测定步骤如下:
①溶液配制:称取5.0g某羟氨样品,溶解在______酸中后加适量蒸馏水,将其全部转移至100mL的______中,加蒸馏水至_______。
②取20.00mL的羟氨酸性溶液与足量硫酸铁在煮沸条件下反应:2NH2OH2++4Fe3+=N2O↑+4Fe2++H2O+6H+,生成的Fe2+用0.4000 mol·L-1的酸性KMnO4溶液滴定,滴定达到终点的现象是____________。请写出Fe2+与酸性KMnO4溶液反应的离子方程式_____________。重复滴定3次,每次消耗酸性高锰酸钾标准溶液的体积如表所示:
![]()
计算试样的纯度____%。
(3)下列操作导致误差偏高的有______(填编号)。
a 滴定前滴定管尖嘴处有气泡,滴定后消失
b 滴定管未经润洗盛装KMnO4溶液
c 羟氨称量时,时间过长和溶解时没有及时用酸酸化
d KMnO4溶液起始读数仰视,终点正常读数
【答案】![]() 硫酸 容量瓶 刻度线 当最后一滴滴入时,锥形瓶中溶液的颜色由无色变为紫红色,且半分钟不褪色 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 66 ab
硫酸 容量瓶 刻度线 当最后一滴滴入时,锥形瓶中溶液的颜色由无色变为紫红色,且半分钟不褪色 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 66 ab
【解析】
(1)根据羟氨化学式写出其电子式;
(2)①羟氨应溶解在H2SO4中,因为HCl中的Cl会被MnO4-氧化;
②用酸性KMnO4溶液滴定达到终点的现象是当最后一滴滴入时,锥形瓶中溶液的颜色由无色变为紫红色,且半分钟不褪色;根据氧化还原反应的规律写出Fe2+与酸性KMnO4溶液反应的离子方程式,根据物质的量的关系计算式样纯度;
(3)根据氧化还原滴定的相关操作分析实验误差。
(1)根据羟氨化学式NH2OH可知其电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)①羟氨应溶解在H2SO4中,因为HCl中的Cl会被MnO4-氧化,将其全部转移至100mL的容量瓶中,加蒸馏水至刻度线,故答案为:硫酸;容量瓶;刻度线;
②用酸性KMnO4溶液滴定达到终点的现象是当最后一滴滴入时,锥形瓶中溶液的颜色由无色变为紫红色,且半分钟不褪色;根据氧化还原反应的规律写出Fe2+与酸性KMnO4溶液反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;由消耗高锰酸钾体积表可知,第一次误差过大,舍去,V(平均)=![]() =20.00mL;
=20.00mL;
设滴定时NH2OH2+的物质的量为xmol,依据离子方程式可得关系式:
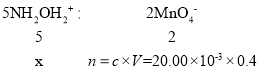
解得x=0.02
因总量为100mL,所以n(NH2OH2+)=0.02×5=0.1mol
m=n![]() M=0.1×33g/mol=3.3g
M=0.1×33g/mol=3.3g
w=![]() =
=![]() 100%=66%
100%=66%
故答案为:当最后一滴滴入时,锥形瓶中溶液的颜色由无色变为紫红色,且半分钟不褪色;5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;66;
(3)a.滴定前滴定管尖嘴处有气泡,滴定后消失会导致V标准偏大,计算结果偏高;
b.滴定管未经润洗盛装KMnO4溶液,相当于把KMnO4溶液稀释,滴定时消耗体积增大,计算结果偏高;
c.羟氨称量时,时间过长和溶解时没有及时用酸酸化会导致羟氨被氧化,导致消耗体积偏小,计算结果偏低;
d.KMnO4溶液起始读数仰视,终点正常读数,导致消耗体积偏小,计算结果偏低;
故答案为:ab。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】改变0.1![]() 二元弱酸
二元弱酸![]() 溶液的pH,溶液中的
溶液的pH,溶液中的![]() 、
、![]() 、
、![]() 的物质的量分数
的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是( )
A. pH=1.2时, ![]()
B. ![]()
C. pH=2.7时, ![]()
D. pH=4.2时, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.凡是放热反应都是自发的,凡是吸热反应都是非自发的
B.自发反应一定是放热反应,非自发反应一定是吸热反应
C.自发反应在恰当条件下才能实现
D.自发反应在任何条件下都能实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,恒容密闭容器中,可逆反应H2(g)+I2(g)![]() 2HI(g)达到化学平衡状态的标志是
2HI(g)达到化学平衡状态的标志是
A.混合气体的压强不再变化B.混合气体的颜色不再变化
C.反应速率v(H2)=0.5v (HI)D.c(H2):c(I2):c(HI)=1:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 恒温恒压下,在容积可变的器皿中,反应2NO2 (g)![]() N2O4 (g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
N2O4 (g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A.减小 B.增大 C.不变 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,可以用作新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过。下列说法不正确的是

A. 放电时,负极反应式:Li-e- =Li+
B. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗标准状况下11.2 L O2
C. 放电时,随外电路中电子的转移,水性电解液中离子总数减少
D. Li+穿过固体电解质向正极移动而得到LiOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表记录了t℃时的4份相同的硫酸铜溶液中加入无水硫酸铜的质量以及析出的硫酸 铜晶体(CuSO4·5H2O)的质量(温度保持不变)的实验数椐:
硫酸铜溶液 | ① | ② | ③ | ④ |
加入的无水硫酸铜(g) | 3.00 | 5.50 | 8.50 | 10.00 |
析出的硫酸铜晶体(g) | 1.00 | 5.50 | 10.90 | 13.60 |
当加入6.20g无水硫酸铜时,析出硫酸铜晶体的质量(g)为
A.7.70B.6.76C.5.85D.9.00
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炔烃的偶联反应在开发新型发光材料、超分子等领域有重要研究价值。乙炔发生的偶联反应为 2CH≡CH ![]() CH≡CC≡CH+H2。乙炔偶联反应过程中能量变化如图甲中曲线Ⅰ所示,曲线Ⅱ为改变某一条件的能量变化。下列说法不正确的是( )
CH≡CC≡CH+H2。乙炔偶联反应过程中能量变化如图甲中曲线Ⅰ所示,曲线Ⅱ为改变某一条件的能量变化。下列说法不正确的是( )
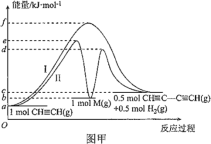
A.曲线Ⅰ,反应物的总键能大于生成物的总键能
B.曲线Ⅱ改变的条件是加入了催化剂
C.曲线Ⅱ对应条件下,第一步反应的 ΔH=+(b-a)kJ·mol-1
D.曲线Ⅱ对应条件下,决定总反应速率的大小是第二步反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol·L-1HCl溶液滴定0.1mol·L-1 NH3·H2O溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列说法不正确的是
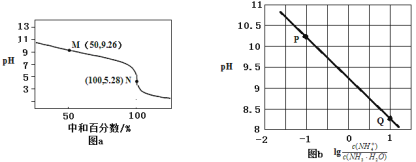
A.Kb(NH3·H2O)的数量级为10-5
B.P到Q过程中,水的电离程度逐渐增大
C.当滴定至溶液呈中性时,c(NH4+)>c(NH3·H2O)
D.N点,c(Cl- ) - c(NH4+)=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com