
【题目】炔烃的偶联反应在开发新型发光材料、超分子等领域有重要研究价值。乙炔发生的偶联反应为 2CH≡CH ![]() CH≡CC≡CH+H2。乙炔偶联反应过程中能量变化如图甲中曲线Ⅰ所示,曲线Ⅱ为改变某一条件的能量变化。下列说法不正确的是( )
CH≡CC≡CH+H2。乙炔偶联反应过程中能量变化如图甲中曲线Ⅰ所示,曲线Ⅱ为改变某一条件的能量变化。下列说法不正确的是( )
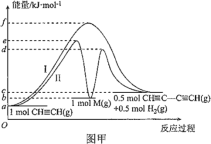
A.曲线Ⅰ,反应物的总键能大于生成物的总键能
B.曲线Ⅱ改变的条件是加入了催化剂
C.曲线Ⅱ对应条件下,第一步反应的 ΔH=+(b-a)kJ·mol-1
D.曲线Ⅱ对应条件下,决定总反应速率的大小是第二步反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是
A.离子结构示意图:![]() 可以表示16O2-,也可以表示18O2-
可以表示16O2-,也可以表示18O2-
B.比例模型:![]() 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子
C.氯化铵的电子式为:![]()
D.二氧化碳分子的比例模型是: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氨(NH2OH)是一种还原剂,和联氨一样是一种弱碱,不稳定,室温下吸收水汽迅速分解。回答下列问题:
(1)请写出羟氨的电子式___。
(2)利用KMnO4标准溶液定量间接测定羟氨的纯度。测定步骤如下:
①溶液配制:称取5.0g某羟氨样品,溶解在______酸中后加适量蒸馏水,将其全部转移至100mL的______中,加蒸馏水至_______。
②取20.00mL的羟氨酸性溶液与足量硫酸铁在煮沸条件下反应:2NH2OH2++4Fe3+=N2O↑+4Fe2++H2O+6H+,生成的Fe2+用0.4000 mol·L-1的酸性KMnO4溶液滴定,滴定达到终点的现象是____________。请写出Fe2+与酸性KMnO4溶液反应的离子方程式_____________。重复滴定3次,每次消耗酸性高锰酸钾标准溶液的体积如表所示:
![]()
计算试样的纯度____%。
(3)下列操作导致误差偏高的有______(填编号)。
a 滴定前滴定管尖嘴处有气泡,滴定后消失
b 滴定管未经润洗盛装KMnO4溶液
c 羟氨称量时,时间过长和溶解时没有及时用酸酸化
d KMnO4溶液起始读数仰视,终点正常读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
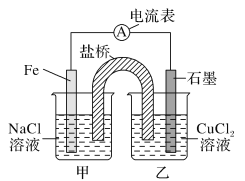
(1)如图为某实验小组依据的氧化还原反应:(用离子方程式表示)______设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为:_________,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因_____。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示:
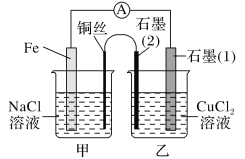
一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是_____,电极反应为______________;乙装置中与铜丝相连石墨(2)电极上发生的反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol CH4气体完全燃烧放出的热量为802 kJ,但当不完全燃烧生成CO和H2O时,放出的热量为519 kJ。如果1 mol CH4与一定量O2燃烧生成CO、CO2、H2O,并放出731.25 kJ的热量,则一定量O2的质量为( )
A. 40 g B. 56 g
C. 60 g D. 64 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
A.常温下,中性溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 能大量共存
能大量共存
B.向含有![]() 的溶液中通入
的溶液中通入![]() 充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2
充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2
C.向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3-
D.向![]() 溶液中滴加少量氯水,再加入
溶液中滴加少量氯水,再加入![]() 溶液振荡,静置,有机层呈橙色
溶液振荡,静置,有机层呈橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾(KMnO4)和双氧水(H2O2)都是常见物质。
(1)写出二者共同元素的原子最外层轨道表示式:___________K在周期表的位置是 ___________ ;25Mn属于_____________族元素。
(2)双氧水(H2O2)和水都是极弱电解质,但H2O2比H2O更显酸性。若把H2O2看成是二元弱酸,请写出它在水中的电离方程式:_____________
(3)2g高锰酸钾溶于10ml水时溶液没有明显的温度变化,请解释理由__________________________________,氧化剂一般来说,酸性越强其氧化性也越强,因此常用酸化的高锰酸钾作氧化剂。用高锰酸钾法测定H2O2时,不能用HCl来酸化原因是_________________;
(4)往H2O2水溶液中滴入一滴酸性KMnO4溶液,从溶液内部析出大量无色气泡。写出可能的化学反应方程式。_____________________________________
(5)往H2O2水溶液中滴入酸性KMnO4溶液,下列方程式错误的是__________
A 3H2O2+2KMnO4+3H2SO4→K2SO4+2MnSO4+6H2O+4O2↑
B 5H2O2+2KMnO4+3H2SO4→K2SO4+2MnSO4+8H2O+5O2↑
C 7H2O2+2KMnO4+3H2SO4→K2SO4+2MnSO4+10H2O+6O2↑
D 9H2O2+2KMnO4+3H2SO4→K2SO4+2MnSO4+12H2O+7O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环已醇被高锰酸钾“氧化”发生的主要反应为![]() KOOC(CH2)4COOK ΔH<0,(高锰酸钾还原产物为MnO2)实验过程:在四口烧瓶装好药品,打开电动搅拌,加热,滴加环己醇,装置如图。 下列说法不正确的是
KOOC(CH2)4COOK ΔH<0,(高锰酸钾还原产物为MnO2)实验过程:在四口烧瓶装好药品,打开电动搅拌,加热,滴加环己醇,装置如图。 下列说法不正确的是
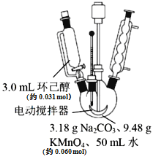
A.“氧化”过程应采用热水浴加热
B.装置中用到的球形冷凝管也可以用于蒸馏分离实验
C.滴加环己醇时不需要打开恒压滴液漏斗上端活塞
D.在滤纸上点1滴反应后混合物,未出现紫红色,则反应已经完成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异戊酸薄荷酯(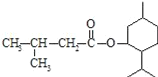 )是一种治疗心脏病的药物,可由甲基丙烯、丙烯和
)是一种治疗心脏病的药物,可由甲基丙烯、丙烯和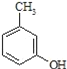 为原料制取。完成下列填空:
为原料制取。完成下列填空:
(1)制取异戊酸薄荷酯的最后一步为酯化反应,其反应物的结构简式为:______
(2) 的名称______,其属于芳香族化合物的同分异构有___种(不含
的名称______,其属于芳香族化合物的同分异构有___种(不含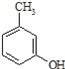 )
)
(3)制取异戊酸薄荷酯的流程中,有一步反应为: +CH3﹣CH=CH2
+CH3﹣CH=CH2![]()
 反应类型属于______反应。有机反应中通常副反应较多,实际生产中发现生成
反应类型属于______反应。有机反应中通常副反应较多,实际生产中发现生成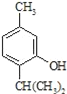 的量远大于生成
的量远大于生成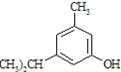 的量,试分析其原因:______
的量,试分析其原因:______
(4)甲基丙烯是重要的化工原料,请设计一条由苯和甲基丙烯通过三步反应制取化工中间体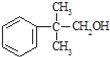 的合成线路______
的合成线路______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com