
【题目】称取10g含杂质的Na2CO3样品(杂质不参与反应),加入100 mL(设密度为1.0g·mL-1)稀盐酸,充分反应后烧杯中剩余物质的总质量为106.48g(生成的气体全部逸出),碳酸钠样品的纯度为 _______________________。若将反应后的溶液加水稀释到400mL,测得溶液的pH为1,则原稀盐酸的物质的量浓度为 _________________ mol·L-1。
【答案】84.8% 2.000
【解析】
碳酸钠与盐酸发生反应:Na2CO3+2HCl=2NaCl+H2O+CO2,反应后溶液显酸性说明碳酸根完全反应,根据反应前后质量差可求出生成的气体质量,从而可以确定碳酸钠的量以及盐酸的浓度。
反应前反应物总质量为:100mL×1.0g·mL-1+10g=110g,则生成的气体即二氧化碳的质量m(CO2)=110g-106.48g=3.52g,则n(CO2)=![]() ,根据反应方程式可知n(Na2CO3)= n(CO2)=0.08mol,所以碳酸钠样品的纯度w(Na2CO3)=
,根据反应方程式可知n(Na2CO3)= n(CO2)=0.08mol,所以碳酸钠样品的纯度w(Na2CO3)=![]() = 84.8%;
= 84.8%;
pH=1,即稀释后c(H+)=0.1mol/L,则反应完全后剩余的n(H+)=0.1mol/L×0.4L=0.04mol,根据方程式可知与碳酸钠反应的盐酸的物质的量n(HCl)=2 n(CO2)=0.16mol,所以原溶液中n(HCl)=0.04mol+0.16mol=0.2mol,浓度c=![]() ,故答案为:84.8%;2.000。
,故答案为:84.8%;2.000。


科目:高中化学 来源: 题型:
【题目】在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1(N2的键能为942kJ·mol-1),晶体片段结构如右图所示。又发现利用N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是( )
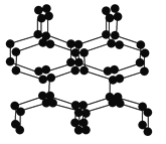
A. 按键型分类,该晶体中含有非极性共价键
B. 含N5+离子的化合物中既有离子键又有共价键
C. 高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D. 这种固体的可能潜在应用是烈性炸药或高能材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
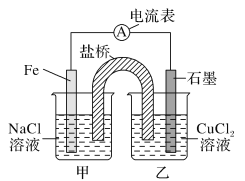
(1)如图为某实验小组依据的氧化还原反应:(用离子方程式表示)______设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为:_________,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因_____。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示:
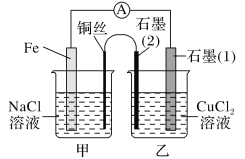
一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是_____,电极反应为______________;乙装置中与铜丝相连石墨(2)电极上发生的反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
A.常温下,中性溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 能大量共存
能大量共存
B.向含有![]() 的溶液中通入
的溶液中通入![]() 充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2
充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2
C.向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3-
D.向![]() 溶液中滴加少量氯水,再加入
溶液中滴加少量氯水,再加入![]() 溶液振荡,静置,有机层呈橙色
溶液振荡,静置,有机层呈橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾(KMnO4)和双氧水(H2O2)都是常见物质。
(1)写出二者共同元素的原子最外层轨道表示式:___________K在周期表的位置是 ___________ ;25Mn属于_____________族元素。
(2)双氧水(H2O2)和水都是极弱电解质,但H2O2比H2O更显酸性。若把H2O2看成是二元弱酸,请写出它在水中的电离方程式:_____________
(3)2g高锰酸钾溶于10ml水时溶液没有明显的温度变化,请解释理由__________________________________,氧化剂一般来说,酸性越强其氧化性也越强,因此常用酸化的高锰酸钾作氧化剂。用高锰酸钾法测定H2O2时,不能用HCl来酸化原因是_________________;
(4)往H2O2水溶液中滴入一滴酸性KMnO4溶液,从溶液内部析出大量无色气泡。写出可能的化学反应方程式。_____________________________________
(5)往H2O2水溶液中滴入酸性KMnO4溶液,下列方程式错误的是__________
A 3H2O2+2KMnO4+3H2SO4→K2SO4+2MnSO4+6H2O+4O2↑
B 5H2O2+2KMnO4+3H2SO4→K2SO4+2MnSO4+8H2O+5O2↑
C 7H2O2+2KMnO4+3H2SO4→K2SO4+2MnSO4+10H2O+6O2↑
D 9H2O2+2KMnO4+3H2SO4→K2SO4+2MnSO4+12H2O+7O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al—PMOF其结构如图(分子式:C4H9XYZ),可快速将芥子气降解为无毒物质。其中X、Y、Z为短周期元素且原子序数依次增大,X、Y同主族。下列说法不正确的是
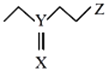
A.简单离子半径:Y>Z> XB.最简单氢化物稳定性:X >Z>Y
C.含氧酸酸性:Z>YD.YXZ2中Y的化合价为+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环已醇被高锰酸钾“氧化”发生的主要反应为![]() KOOC(CH2)4COOK ΔH<0,(高锰酸钾还原产物为MnO2)实验过程:在四口烧瓶装好药品,打开电动搅拌,加热,滴加环己醇,装置如图。 下列说法不正确的是
KOOC(CH2)4COOK ΔH<0,(高锰酸钾还原产物为MnO2)实验过程:在四口烧瓶装好药品,打开电动搅拌,加热,滴加环己醇,装置如图。 下列说法不正确的是
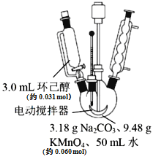
A.“氧化”过程应采用热水浴加热
B.装置中用到的球形冷凝管也可以用于蒸馏分离实验
C.滴加环己醇时不需要打开恒压滴液漏斗上端活塞
D.在滤纸上点1滴反应后混合物,未出现紫红色,则反应已经完成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年2月15日,由国家科研攻关组的主要成员单位的专家组共同研判磷酸氯喹在细胞水平上能
有效抑制新型冠状病毒(2019-nCoV)的感染。
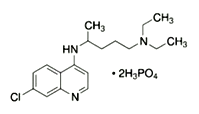
(1)已知磷酸氯喹的结构如图所示,则所含C、N、O三种元素第一电离能由大到小的顺序为_______________。P原子核外价层电子排布式为________,其核外电子有____个空间运动状态。
(2)磷酸氯喹中N原子的杂化方式为_________,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是_______________________。
(3)H3PO4中PO43- 的空间构型为________________。
(4)磷化镓是一种由ⅢA族元素镓(Ga)与VA族元素磷(P)人工合成的Ⅲ—V族化合物半导体材料。晶胞结构可看作金刚石晶胞内部的碳原子被P原子代替,顶点和面心的碳原子被Ga原子代替。
①磷化镓晶体中含有的化学键类型为__________(填选项字母)
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如图,则原子2的分数坐标为______________。

③若磷化镓的晶体密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生反应:2HI(g)![]() H2(g)+I2(g),0~15 s内c(HI)由0.1 mol/L降到0.07 mol/L,则下列说法正确的是 ( )
H2(g)+I2(g),0~15 s内c(HI)由0.1 mol/L降到0.07 mol/L,则下列说法正确的是 ( )
A. 当HI、H2、I2浓度之比为2∶1∶1时,说明该反应达平衡
B. c(HI)由0.07 mol/L降到0.05 mol/L所需的反应时间小于10 s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 0~15s内用I2表示的平均反应速率为:v(I2)=0.001 mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com