
【题目】PLLA塑料不仅具有良好的机械性能,还具有良好的可降解性。它可由石油裂解气为原料合成。下列框图是以石油裂解气为原料来合成PLLA塑料的流程图(图中有部分产物及反应条件未列出)。

请回答下列问题:
(1)属于取代反应的有______________(填编号)。
(2)写出下列反应的化学方程式:
反应③:________________________________;
反应⑤:______________________________。
(3)已知E(C3H6O3)存在三种常见不同类别物质的异构体,请各举一例(E除外)并写出其结构简式:______________________、__________________、_______________。
(4)请写出一定条件下PLLA废弃塑料降解的化学方程式___________________________。
(5)已知:![]() ,炔烃也有类似的性质,设计丙烯合成
,炔烃也有类似的性质,设计丙烯合成![]() 的合成路线_______
的合成路线_______
(合成路线常用的表示方法为:A![]() B……
B……![]() 目标产物)
目标产物)
【答案】③⑧ ![]() +2NaOH
+2NaOH![]()
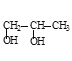 +2NaBr
+2NaBr 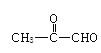 +2Cu(OH)2
+2Cu(OH)2![]() CH3COCOOH+Cu2O+2H2O
CH3COCOOH+Cu2O+2H2O ![]()
![]() CH3COOCH2OH
CH3COOCH2OH ![]() +nH2O
+nH2O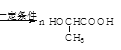
【解析】
根据PLLA的结构简式可知E的结构简式为:![]() ,两分子
,两分子![]() 通过反应⑧酯化反应生成F;D与氢气通过反应⑥生成E,则D的结构简式为:CH3COCOOH;C通过反应
通过反应⑧酯化反应生成F;D与氢气通过反应⑥生成E,则D的结构简式为:CH3COCOOH;C通过反应![]() 生成D,则C为
生成D,则C为![]() ;B通过反应④加热氧化成C,则B为
;B通过反应④加热氧化成C,则B为![]() ;A通过反应③
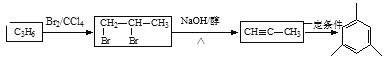
;A通过反应③![]() 生成B,丙烯通过与溴发生加成反应生成A,则A为
生成B,丙烯通过与溴发生加成反应生成A,则A为![]() ;反应①为丁烷分解生成甲烷和丙烯,据此进行解答。
;反应①为丁烷分解生成甲烷和丙烯,据此进行解答。
根据PLLA的结构简式可知E的结构简式为:![]() ,两分子
,两分子![]() 通过反应⑧酯化反应生成F;D与氢气通过反应⑥生成E,则D的结构简式为:CH3COCOOH;C通过反应
通过反应⑧酯化反应生成F;D与氢气通过反应⑥生成E,则D的结构简式为:CH3COCOOH;C通过反应![]() 生成D,则C为
生成D,则C为![]() ;B通过反应④加热氧化成C,则B为
;B通过反应④加热氧化成C,则B为![]() ;A通过反应③
;A通过反应③![]() 生成B,丙烯通过与溴发生加成反应生成A,则A为
生成B,丙烯通过与溴发生加成反应生成A,则A为![]() ;
;
(1)反应①为分解反应,反应②为加成反应,反应③为取代反应,反应④⑤为氧化反应,反应⑥为加成反应,反应⑦缩聚反应,反应⑧为酯化反应,也属于取代反应,所以属于取代反应为③⑧;
(2)过反应③的化学方程式为:![]() ;
;
反应⑤的化学方程式为:![]() ;
;
(3)E的结构简式为![]() ,E存在三种常见不同类别物质的异构体有:
,E存在三种常见不同类别物质的异构体有:![]() 、
、![]() 、
、![]() ;
;
(4)PLLA废弃塑料降解生成![]() ,反应的化学方程式为:
,反应的化学方程式为:![]() ;
;
(5)根据逆合成法可知,![]() 可以通过丙炔通过信息反应合成,丙炔可以用丙烯分别通过加聚反应、水解反应、消去反应获得,所以合成路线为:
可以通过丙炔通过信息反应合成,丙炔可以用丙烯分别通过加聚反应、水解反应、消去反应获得,所以合成路线为: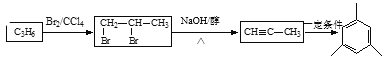 。
。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
【题目】草酸铵[(NH4)2C2O4]为无色柱状晶体,不稳定,受热易分解,可用于测定Ca2+、Mg2+的含量。
I.某同学利用如图所示实验装置检验草酸铵的分解产物。
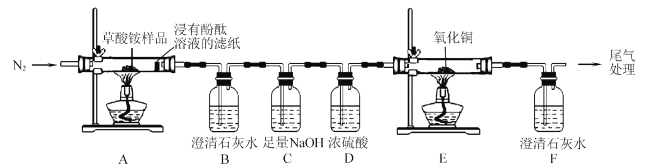
(l)实验过程中,观察到浸有酚酞溶液的滤纸变红,装置B中澄清石灰水变浑浊,说明分解产物中含有____(填化学式);若观察到____, 说明分解产物中含有CO2草酸铵分解的化学方程式为____。
(2)反应开始前,通人氮气的目的是____。
(3)装置C的作用是 ____。
(4)还有一种分解产物在一定条件下也能还原CuO,该反应的化学方程式为 _____。
Ⅱ.该同学利用草酸铵测定血液中钙元素的含量。
(5)取20. 00mL血液样品,定容至l00mL,分别取三份体积均为25. 00mL稀释后的血液样品,加入草酸铵,生成草酸钙沉淀,过滤,将该沉淀溶于过量稀硫酸中,然后用0. 0l00mol/LKMnO4溶液进行滴定。滴定至终点时的实验现象为____。三次滴定实验消耗KMnO4溶液的体积分别为0.43mL,0.4lmL,0.52mL,则该血液样品中钙元素的含量为__________ mmol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电化学技术作为一种新型水处理工艺,因具有污染物同步去除和能源化的特点而受到广泛关注。一种典型的乙酸降解微生物电化学系统(MES)工作原理如下图所示。下列说法错误的是
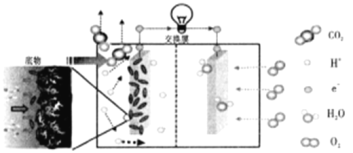
A.MES系统中的交换膜为阳离子交换膜
B.乙酸降解过程中,若电路中流过2 mol电子,则理论上右室需要通入O2约11.2L
C.通入O2的一极为正极,发生还原反应
D.逸出CO2的一侧电极反应式为CH3COOH-8e-+2H2O=2CO2↑+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如右图。若上端开口关闭,可得到强还原性的H·(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(羟基自由基)。下列说法正确的是

A. 无论是否鼓入空气,负极的电极反应式均为Fe-3e-= Fe3+
B. 鼓入空气时,每生成1mol·OH有2mol电子发生转移
C. 不鼓入空气时,正极的电极反应式为H+ + e- = H·
D. 处理含有C2O42-的污水时,上端开口应关闭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
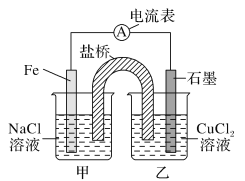
(1)如图为某实验小组依据的氧化还原反应:(用离子方程式表示)______设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为:_________,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因_____。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示:
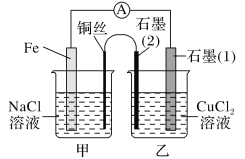
一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是_____,电极反应为______________;乙装置中与铜丝相连石墨(2)电极上发生的反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,0.1000mol·L-lCH3COOH溶液中CH3COOH的电离度(×100%)约为1%。该温度下,用0.1000mol·L-l氨水滴定10.00mL0.1000mol·L-lCH3COOH溶液,溶液的pH与溶液的导电能力(I)的关系如图所示。下列说法中正确的是( )
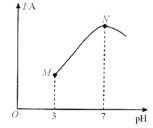
A.M点→N点,水的电离程度逐渐增大
B.25℃时,CH3COOH 的电离常数约为1.0×10-2
C.N点溶液中,c(CH3COO-)>c(NH4+)
D.当滴入20 mL氨水时,溶液中c(CH3COO-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
A.常温下,中性溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 能大量共存
能大量共存
B.向含有![]() 的溶液中通入
的溶液中通入![]() 充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2
充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2
C.向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3-
D.向![]() 溶液中滴加少量氯水,再加入
溶液中滴加少量氯水,再加入![]() 溶液振荡,静置,有机层呈橙色
溶液振荡,静置,有机层呈橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al—PMOF其结构如图(分子式:C4H9XYZ),可快速将芥子气降解为无毒物质。其中X、Y、Z为短周期元素且原子序数依次增大,X、Y同主族。下列说法不正确的是
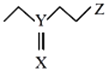
A.简单离子半径:Y>Z> XB.最简单氢化物稳定性:X >Z>Y
C.含氧酸酸性:Z>YD.YXZ2中Y的化合价为+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物在工业上有着广泛的应用。完成下列填空:
(1)写出工业上以硫磺为原料生产硫酸的第一步反应方程式______
(2)工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,主要反应如下:____Mn2++____S2O82﹣+____H2O→____MnO4﹣+____SO42﹣+______H+。配平该反应方程式,氧化产物是______
(3)用电解硫酸氢钾的方法制取过硫酸钾:HSO4﹣在______(填:“阳极”或“阴极”)反应生成S2O82﹣,另一极生成氢气,生成0.1mol的S2O82﹣同时可收集到______g氢气
(4)已知硫酸的第二级电离并不完全:HSO4﹣![]() H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是____,第4位的离子是____。往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中
H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是____,第4位的离子是____。往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中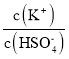 ____(填:“增大”、“减小”或“不变”)
____(填:“增大”、“减小”或“不变”)
(5)已知:HSO3﹣H++SO32﹣K=1.02×10﹣7,NH4++H2ONH3H2O+H+ K=5.65×10﹣10。往亚硫酸氢铵中加入一定量的氢氧化钡溶液,可能发生的反应离子方程式是____(选填编号)
a.HSO3﹣+Ba2++OH﹣=BaSO3↓+H2O
b.NH4++2HSO3﹣+2Ba2++3OH﹣=2BaSO3↓+2H2O+NH3H2O
c.NH4++HSO3﹣+Ba2++2OH﹣=BaSO3↓+H2O+NH3H2O
d.2NH4++4HSO3﹣+3Ba2++6OH﹣=3BaSO3↓+4H2O+2NH3H2O+SO32﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com