
【题目】草酸铵[(NH4)2C2O4]为无色柱状晶体,不稳定,受热易分解,可用于测定Ca2+、Mg2+的含量。
I.某同学利用如图所示实验装置检验草酸铵的分解产物。
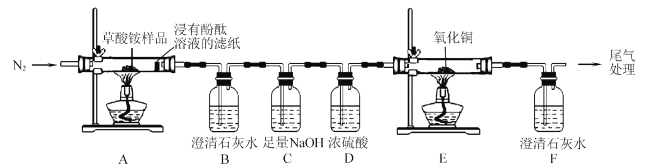
(l)实验过程中,观察到浸有酚酞溶液的滤纸变红,装置B中澄清石灰水变浑浊,说明分解产物中含有____(填化学式);若观察到____, 说明分解产物中含有CO2草酸铵分解的化学方程式为____。
(2)反应开始前,通人氮气的目的是____。
(3)装置C的作用是 ____。
(4)还有一种分解产物在一定条件下也能还原CuO,该反应的化学方程式为 _____。
Ⅱ.该同学利用草酸铵测定血液中钙元素的含量。
(5)取20. 00mL血液样品,定容至l00mL,分别取三份体积均为25. 00mL稀释后的血液样品,加入草酸铵,生成草酸钙沉淀,过滤,将该沉淀溶于过量稀硫酸中,然后用0. 0l00mol/LKMnO4溶液进行滴定。滴定至终点时的实验现象为____。三次滴定实验消耗KMnO4溶液的体积分别为0.43mL,0.4lmL,0.52mL,则该血液样品中钙元素的含量为__________ mmol/L。
【答案】NH3、CO2 E中黑色固体变红,F中澄清石灰水变浑浊 (NH4)2C2O4![]() 2NH3↑+CO2↑+CO↑+H2O 排尽装置中的空气 充分吸收CO2,防止干扰CO的检验 2NH3+3CuO
2NH3↑+CO2↑+CO↑+H2O 排尽装置中的空气 充分吸收CO2,防止干扰CO的检验 2NH3+3CuO![]() 3Cu+N2+3H2O 因最后一滴KMnO4溶液的滴入,溶液变为粉红色,且半分钟内不褪去 2.1
3Cu+N2+3H2O 因最后一滴KMnO4溶液的滴入,溶液变为粉红色,且半分钟内不褪去 2.1
【解析】
(l)按实验过程中观察到现象,推测分解产物并书写草酸铵分解的化学方程式;
(2) 氮气驱赶装置内原有气体,从空气对实验不利因素来分析;
(3)由所盛装的物质性质及实验目的推测装置C的作用;
(4)从分解产物中找到另一个有还原性的物质,结合氧化还原反应原理写该反应的化学方程式;
Ⅱ.(5)三次平行实验,计算时要数据处理,结合关系式进行计算;
(l)实验过程中,观察到浸有酚酞溶液的滤纸变为红色说明分解产物中含有氨气,装置B中澄清石灰水变浑浊,说明分解产物中含有二氧化碳气体;若观察到装置E中氧化铜由黑色变为红色,装置F中澄清石灰水变浑浊,说明分解产物中含有CO;
答案为:NH3;CO2 ; E中黑色固体变红,F中澄清石灰水变浑浊;
草酸铵分解产生了CO2、NH3、CO,结合质量守恒定律知,另有产物H2O,则草酸铵分解的化学方程式为(NH4)2C2O4![]() 2NH3↑+CO2↑+CO↑+H2O;
2NH3↑+CO2↑+CO↑+H2O;
答案为:(NH4)2C2O4![]() 2NH3↑+CO2↑+CO↑+H2O;
2NH3↑+CO2↑+CO↑+H2O;
(2)反应开始前,通人氮气的目的是排尽装置中的空气,避免CO与空气混合加热发生爆炸,并防止空气中的CO2干扰实验;
答案为:排尽装置中的空气;
(3) 装置E和F是验证草酸铵分解产物中含有CO,所以要依次把分解产生的CO2、气体中的水蒸气除去,所以装置C的作用是:吸收CO2,避免对CO的检验产生干扰;
答案为:充分吸收CO2,防止干扰CO的检验;
(4)还有一种分解产物在一定条件下也能还原CuO,那就是氨气,NH3也会与CuO反应,其产物是N2和水,该反应的化学方程式为2NH3+3CuO![]() 3Cu+N2+3H2O;
3Cu+N2+3H2O;
答案为:2NH3+3CuO![]() 3Cu+N2+3H2O;
3Cu+N2+3H2O;
(5)草酸钙沉淀溶于过量稀硫酸中得到草酸,用0. 0l00mol/LKMnO4溶液进行滴定,反应为![]() ,滴定至终点时,因最后一滴KMnO4溶液的滴入,溶液变为粉红色,且半分钟内不褪去;
,滴定至终点时,因最后一滴KMnO4溶液的滴入,溶液变为粉红色,且半分钟内不褪去;
答案为:因最后一滴KMnO4溶液的滴入,溶液变为粉红色,且半分钟内不褪去;
三次滴定实验消耗KMnO4溶液的体积分别为0.43mL,0.4lmL,0.52mL,应舍弃0.52mL,误差较大,则平均体积为0.42mL,滴定反应为![]() ,
,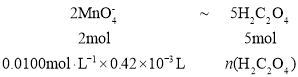 ;
; ![]() =1.05×105mol,所以20mL血液样品中含有的钙元素的物质的量为
=1.05×105mol,所以20mL血液样品中含有的钙元素的物质的量为![]() ,即4.2×102mmol,则该血液中钙元素的含量为
,即4.2×102mmol,则该血液中钙元素的含量为![]() ;
;
答案为:2.1。


科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
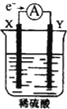
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以钒钛磁铁矿为原料,在炼铁的同时还可以制备钒的最高价氧化物V2O5,其主要流程如下:
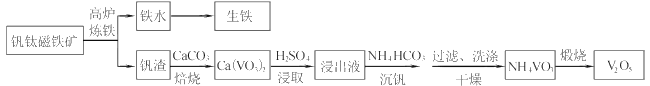
已知:①VO3-+2H+![]() VO2++H2O
VO2++H2O
②NH4VO3微溶于冷水,易溶于热水,不溶于乙醇
(1)高炉炼铁应用的冶炼方法是____(填标号)
A.热分解法 B.热还原法 C.电解法
(2)钒渣中的V2O3在焙烧时转化为Ca(VO3)2,写出该反应的化学方程式__。
(3)Ca(VO3)2难溶于水但能溶于稀硫酸,试用平衡移动原理分析其原因_,浸出液中含钒物质的化学式为___。
(4)沉钒过程有气体生成,其反应的离子方程式为__。
(5)过滤后用乙醇代替水来洗涤沉淀的原因是__。
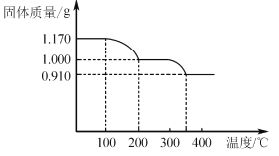
(6)煅烧NH4VO3时,固体质量随温度变化的曲线如图所示。加热到200℃时,得到的固体物质化学式为__,300~350℃放出的气态物质化学式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某弱酸的酸式盐有NaH2XO4和Na2HXO4两种,其中NaH2XO4的溶液呈酸性,Na2HXO4溶液呈碱性。30℃时,NaH2XO4溶液和Na2HXO4溶液,二种溶液的浓度均为0.1mol·L-1,其中均存在的关系是( )
A.c(H+)·c(OH-)=1×10-14
B.c(H+)+2c(H3XO4)+c(H2XO4-)=c(XO43-)+c(OH-)
C.c(Na+)+c(H+)=c(H2XO4-)+c(OH-)+2c(HXO42-)+3c(XO43-)
D.c(H+)+c(H3XO4)=c(HXO42-)+2c(XO43-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的工业制备是一个重要的化工生产过程,但同时在生产过程中会产生大量SO2等污染物。以硫酸工业的尾气、氨水、石灰石、焦炭及氯化钾为原料可以合成有重要用途的硫化钙、硫酸钾、氯化铵、亚硫酸铵等物质。合成路线如下:

完成下列填空:
(1)某电厂每月用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,现用反应Ⅰ的原理将尾气中的SO2转化为石膏,且反应过程中96%的硫转化为石膏,则可生产石膏______ t。
(2)操作a中,必须的操作步骤有蒸发、___________、___________等;
(3)反应Ⅲ中氧化剂与还原剂的物质的量之比为__________;
(4)写出反应Ⅳ的方程式______________ ;操作b所得滤液中阳离子的检验方法是________________。
(5)反应Ⅴ在25℃,40%乙二醇溶液中进行,该复分解反应能顺利进行的原因是___________;
(6)该生产过程中可以循环使用的物质是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g) + I2(?)![]() 2HI(g)+9.48kJ
2HI(g)+9.48kJ
②H2(g) + I2(?)![]() 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是
A.①中的I2为固态,②中的I2为气态
B.②的反应物总能量比①的反应物总能量低
C.①的产物比反应②的产物热稳定性更好
D.1mol 固态碘升华时将吸热17kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的含氧钠盐有许多,现有Na2SO3、Na2S2O3、Na2S2O4(连二亚硫酸钠),其热稳定性比相应的酸强。
已知:2Na2S2O4 =Na2S2O3+Na2SO3+SO2↑
4H++ 2S2O42- = 3SO2↑+ S↓ + 2H2O
完成下列计算:
(1)用Na2S2O3溶液与不同浓度的硫酸反应,可以研究浓度对化学反应速率的影响。现有98%的浓硫酸(密度为1.84g·cm-3)来配制500mL1mol·L(密度为1.06g·cm-3)的稀硫酸,则需要浓硫酸___________mL;加水_______g;
(2)称取部分氧化的亚硫酸钠样品10.16克溶于水,加入稍过量的盐酸酸化了的氯化钡溶液,过滤,洗涤,干燥,所得沉淀质量为2.33克,则该亚硫酸钠中已有_______%(质量分数)的亚硫酸钠被氧化。
(3)现有8.70g的无水Na2S2O4,吸水后得到10.50g Na2S2O4·nH2O,则水合物中n的值是______;
(4)Na2S2O4在500℃时部分分解得产物A,将9.16g产物A中加入足量的稀硫酸中,生成SO21.568L(标准状况),试确定残留物中钠、硫和氧的原子个数比_______;若取另一份Na2S2O4部分分解得到的产物B,则ag产物B中钠、硫和氧的原子个数比为__________(范围)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PLLA塑料不仅具有良好的机械性能,还具有良好的可降解性。它可由石油裂解气为原料合成。下列框图是以石油裂解气为原料来合成PLLA塑料的流程图(图中有部分产物及反应条件未列出)。

请回答下列问题:
(1)属于取代反应的有______________(填编号)。
(2)写出下列反应的化学方程式:
反应③:________________________________;
反应⑤:______________________________。
(3)已知E(C3H6O3)存在三种常见不同类别物质的异构体,请各举一例(E除外)并写出其结构简式:______________________、__________________、_______________。
(4)请写出一定条件下PLLA废弃塑料降解的化学方程式___________________________。
(5)已知:![]() ,炔烃也有类似的性质,设计丙烯合成
,炔烃也有类似的性质,设计丙烯合成![]() 的合成路线_______
的合成路线_______
(合成路线常用的表示方法为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com