
【题目】硫的含氧钠盐有许多,现有Na2SO3、Na2S2O3、Na2S2O4(连二亚硫酸钠),其热稳定性比相应的酸强。
已知:2Na2S2O4 =Na2S2O3+Na2SO3+SO2↑
4H++ 2S2O42- = 3SO2↑+ S↓ + 2H2O
完成下列计算:
(1)用Na2S2O3溶液与不同浓度的硫酸反应,可以研究浓度对化学反应速率的影响。现有98%的浓硫酸(密度为1.84g·cm-3)来配制500mL1mol·L(密度为1.06g·cm-3)的稀硫酸,则需要浓硫酸___________mL;加水_______g;
(2)称取部分氧化的亚硫酸钠样品10.16克溶于水,加入稍过量的盐酸酸化了的氯化钡溶液,过滤,洗涤,干燥,所得沉淀质量为2.33克,则该亚硫酸钠中已有_______%(质量分数)的亚硫酸钠被氧化。
(3)现有8.70g的无水Na2S2O4,吸水后得到10.50g Na2S2O4·nH2O,则水合物中n的值是______;
(4)Na2S2O4在500℃时部分分解得产物A,将9.16g产物A中加入足量的稀硫酸中,生成SO21.568L(标准状况),试确定残留物中钠、硫和氧的原子个数比_______;若取另一份Na2S2O4部分分解得到的产物B,则ag产物B中钠、硫和氧的原子个数比为__________(范围)。
【答案】27.2mL 480 12.6% 2 6:5:10 4:3:6到1:1:2之间
【解析】
(1)先根据c=![]() 计算浓硫酸的浓度,再根据浓硫酸稀释前后溶质的物质的量不变计算浓硫酸的体积;根据稀硫酸溶液的质量=浓硫酸溶液的质量+水的质量来计算溶剂质量;
计算浓硫酸的浓度,再根据浓硫酸稀释前后溶质的物质的量不变计算浓硫酸的体积;根据稀硫酸溶液的质量=浓硫酸溶液的质量+水的质量来计算溶剂质量;
(2)加入稍过量的盐酸酸化了的氯化钡溶液,所得沉淀质量为2.33克,即为硫酸钡的质量,根据硫酸根离子守恒以及化学反应原理来计算;
(3)8.70g的无水Na2S2O4物质的量是0.05mol,吸水后得到10.50g Na2S2O4nH2O,所以0.05molNa2S2O4nH2O中水的质量是10.5g-8.7g=1.8g,据此计算;
(4)2Na2S2O4→Na2S2O3+Na2SO3+SO2↑,4H++2S2O42-→3SO2↑+S↓+2H2O,其中Na2S2O3和Na2SO3物质的量分别为x,结合质量守恒和化学方程式定量关系列式计算,另一份Na2S2O4部分分解得到的产物B,则ag产物能是未分解,也可能是全部分解,据此计算。
(1)质量分数为98%、密度为1.84gcm-3的浓硫酸物质的量浓度为![]() =18.4mol/L,配制溶液时,稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=1molL-1×0.5L,解得:V=0.0272L=27.2mL,500mL1molL(密度为1.06gcm-3)的稀硫酸溶液的质量=浓硫酸的质量+水的质量,设加水的质量是m,则27.2mL×1.84gcm-3+m=500mL×1.06gcm-3,解得m=480g,故答案为:27.2;480;
=18.4mol/L,配制溶液时,稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=1molL-1×0.5L,解得:V=0.0272L=27.2mL,500mL1molL(密度为1.06gcm-3)的稀硫酸溶液的质量=浓硫酸的质量+水的质量,设加水的质量是m,则27.2mL×1.84gcm-3+m=500mL×1.06gcm-3,解得m=480g,故答案为:27.2;480;
(2)加入稍过量的盐酸酸化了的氯化钡溶液,所得沉淀为硫酸钡,质量为2.33g物质的量为![]() =0.01mol,所以被氧化的亚硫酸钠是0.01mol,被氧化亚硫酸钠的质量分数=
=0.01mol,所以被氧化的亚硫酸钠是0.01mol,被氧化亚硫酸钠的质量分数=![]() ×100%=12.6%,故答案为:12.6%;
×100%=12.6%,故答案为:12.6%;
(3)8.70g的无水Na2S2O4,物质的量是![]() =0.05mol,吸水后得到10.50g Na2S2O4nH2O,则水合物中n的值是
=0.05mol,吸水后得到10.50g Na2S2O4nH2O,则水合物中n的值是![]() ×
×![]() =2,故答案为:2;
=2,故答案为:2;
(4)将9.16g产物A中加入足量的稀硫酸中,生成SO21.568L(标准状况)物质的量n=![]() =0.07mol,2Na2S2O4→Na2S2O3+Na2SO3+SO2↑,4H++2S2O42-→3SO2↑+S↓+2H2O,设部分分解后的产物中Na2S2O3和Na2SO3物质的量分别为x,未分解的Na2S2O4 物质的量为y,
=0.07mol,2Na2S2O4→Na2S2O3+Na2SO3+SO2↑,4H++2S2O42-→3SO2↑+S↓+2H2O,设部分分解后的产物中Na2S2O3和Na2SO3物质的量分别为x,未分解的Na2S2O4 物质的量为y,
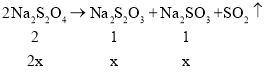
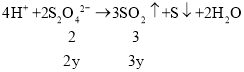
![]()
①1.5y+2x=0.07,②158x+126x+174y=9.16。由①和②解得:x=0.02mol,y=0.02mol;则残留物0.02molNa2S2O4、0.02molNa2S2O3、0.02molNa2SO3中钠、硫和氧的原子个数比为6∶5∶10;另一份Na2S2O4部分分解得到的产物B,则ag产物则ag产物能是未分解,也可能是全部分解,未分解则为Na2S2O4、B中钠、硫和氧的原子个数比为1∶1∶2,如全部分解为等物质的量的Na2S2O3和Na2SO3,钠、硫和氧的原子个数比为4∶3∶6,故答案为:6∶5∶10;4∶3∶6到1∶1∶2之间。


科目:高中化学 来源: 题型:
【题目】利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO3)2,其部分工艺流程如下:
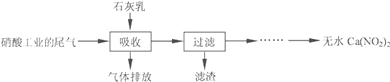
(1)硝酸工业尾气一般用碱液吸收,写出一个吸收尾气离子方程式_____.
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是___;滤渣可循环利用,滤渣的主要成分是____(填化学式).
(3)该工艺需控制NO和NO2物质的量之比接近1:1.若n(NO):n(NO2)>1:1,则会导致____;若n(NO):n(NO2)<1:1,则会导致_____.
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸铵[(NH4)2C2O4]为无色柱状晶体,不稳定,受热易分解,可用于测定Ca2+、Mg2+的含量。
I.某同学利用如图所示实验装置检验草酸铵的分解产物。
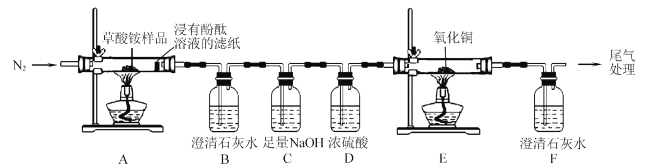
(l)实验过程中,观察到浸有酚酞溶液的滤纸变红,装置B中澄清石灰水变浑浊,说明分解产物中含有____(填化学式);若观察到____, 说明分解产物中含有CO2草酸铵分解的化学方程式为____。
(2)反应开始前,通人氮气的目的是____。
(3)装置C的作用是 ____。
(4)还有一种分解产物在一定条件下也能还原CuO,该反应的化学方程式为 _____。
Ⅱ.该同学利用草酸铵测定血液中钙元素的含量。
(5)取20. 00mL血液样品,定容至l00mL,分别取三份体积均为25. 00mL稀释后的血液样品,加入草酸铵,生成草酸钙沉淀,过滤,将该沉淀溶于过量稀硫酸中,然后用0. 0l00mol/LKMnO4溶液进行滴定。滴定至终点时的实验现象为____。三次滴定实验消耗KMnO4溶液的体积分别为0.43mL,0.4lmL,0.52mL,则该血液样品中钙元素的含量为__________ mmol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)CO2(g)+N2(g)+Q,平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是
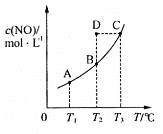
A.该反应的Q >0
B.若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C.在T2时,若反应体系处于状态D,则此时V正>V逆
D.若状态B、C、D的压强分别为PB、PC 、PD ,则 PC=PD>PB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1(N2的键能为942kJ·mol-1),晶体片段结构如右图所示。又发现利用N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是( )
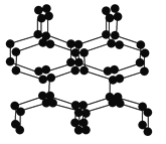
A. 按键型分类,该晶体中含有非极性共价键
B. 含N5+离子的化合物中既有离子键又有共价键
C. 高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D. 这种固体的可能潜在应用是烈性炸药或高能材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镓是由门捷列夫第一个预言成真的元素,有“电子工业脊梁”的美誉,它与铝同主族,其氧化物和氢氧化物均为两性化合物,镓及其化合物应用广泛。粉煤灰中可以提取镓,粉煤灰中的主要成分为Ga2O3,含CaO、SiO2、Al2O3等杂质。镓的熔点较低(29.8℃).沸点很高(2403℃)。
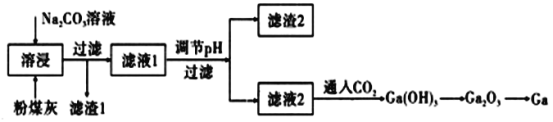
(1)滤渣1的主要成分为:___________。
(2)为了提高溶浸效率可以采用的措施有(写两种):____________。
(3)写出镓单质与氢氧化钠溶液反应的离子方程式:___________。
(4)其他镓的化合物在生活和前沿科技上有广泛应用,根据已学知识回答下列问题:
①GaCl3溶液制备GaCl3固体,应如何操作:_________。
②当代工业上固态氮化镓(GaN)的制备方法是利用镓与NH3在1000℃高温下合成,同时生成氢气,每消耗1 mol Ga时放出15.135 kJ热量。该可逆反应的热化学方程式是______。
(5)下表是两种两性氢氧化物的电离常数。

将一块镓铝合金完全溶于烧碱溶液,再往反应后的溶液中缓缓通入CO2,最先析出的氢氧化物是____。
(6)电解法可以提纯粗镓(内含Zn、Fe、Cu等杂质),以NaOH水溶液为电解质,在阴极析出高纯度的镓,请写出阴极电极反应:_____(离子氧化顺序为:Zn2+<Ga3+<Fe2+)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电化学技术作为一种新型水处理工艺,因具有污染物同步去除和能源化的特点而受到广泛关注。一种典型的乙酸降解微生物电化学系统(MES)工作原理如下图所示。下列说法错误的是
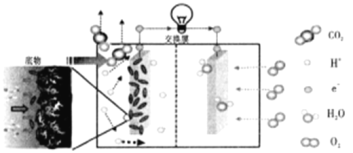
A.MES系统中的交换膜为阳离子交换膜
B.乙酸降解过程中,若电路中流过2 mol电子,则理论上右室需要通入O2约11.2L
C.通入O2的一极为正极,发生还原反应
D.逸出CO2的一侧电极反应式为CH3COOH-8e-+2H2O=2CO2↑+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如右图。若上端开口关闭,可得到强还原性的H·(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(羟基自由基)。下列说法正确的是

A. 无论是否鼓入空气,负极的电极反应式均为Fe-3e-= Fe3+
B. 鼓入空气时,每生成1mol·OH有2mol电子发生转移
C. 不鼓入空气时,正极的电极反应式为H+ + e- = H·
D. 处理含有C2O42-的污水时,上端开口应关闭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al—PMOF其结构如图(分子式:C4H9XYZ),可快速将芥子气降解为无毒物质。其中X、Y、Z为短周期元素且原子序数依次增大,X、Y同主族。下列说法不正确的是
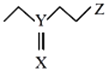
A.简单离子半径:Y>Z> XB.最简单氢化物稳定性:X >Z>Y
C.含氧酸酸性:Z>YD.YXZ2中Y的化合价为+4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com